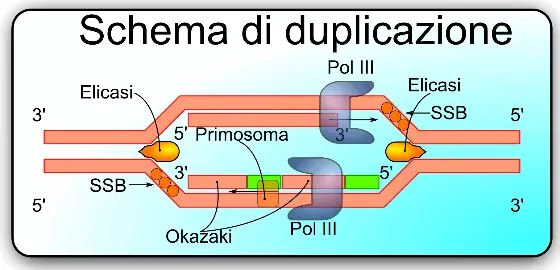
La DNA elicasi è un enzima proteico centrale per la replicazione perché serve per rompere i legami a idrogeno. Prima che si leghi la polimerasi, nel sito di inizio di replicazione si lega l’elicasi. L’elicasi procariotica è formata da 6 subunità identiche che, assemblandosi tra loro, formano un anello intorno al DNA e lo aprono consumando ATP, che viene idrolizzata ad ADP più ortofosfato, quindi per l’apertura del doppio filamento si consuma energia.
La DNA elicasi è un enzima proteico centrale per la replicazione perché serve per rompere i legami a idrogeno. Prima che si leghi la polimerasi, nel sito di inizio di replicazione si lega l’elicasi. L’elicasi procariotica è formata da 6 subunità identiche che, assemblandosi tra loro, formano un anello intorno al DNA e lo aprono consumando ATP, che viene idrolizzata ad ADP più ortofosfato, quindi per l’apertura del doppio filamento si consuma energia. La proteina è formata da varie subunità con struttura secondaria a foglietti-β ed α-elica; nell’interfaccia tra una subunità e l’altra c’è un sito di legame per l’ATP, che poi viene idrolizzato formando l'energia necessaria per aprire la doppia elica.
Nei procarioti esiste una proteina che prende il nome di Proteina che si lega al singolo filamento (SSB). Nonostante che l'elicasi abbia già aperto i filamenti, questi potrebbero richiudersi a formare strutture tridimensionali che impedirebbero la lettura. Le SSB intervengono legandosi come polimero al singolo filamento di DNA e raddrizzando la regione della catena. Le SSB presentano due domini, un dominio A e un dominio B, con una scanalatura in cui passa il filamento di DNA, e interagiscono con lo scheletro di zucchero-fosfato e le basi azotate vengono esposte e possono essere lette.
La DNA polimerasi legandosi al DNA riesce a percorrere un breve tratto di DNA e poi si dissocia, la sua affinità con il DNA non è molto alta, per questo ci sono proteine aggiuntive dette pinza e caricatore della pinza. La pinza ha la forma di ciambella costituita da due subunità che si accoppiano prima della DNA polimerasi. Per dimerizzare le due subunità è necessario il caricatore della pinza, che utilizza ATP. Il legame della DNA polimerasi alla pinza dissocia il caricatore della pinza e permette lo scorrimento del complesso.
Nel filamento principale il complesso rimane associato fino alla fine della replicazione; nel filamento ritardato invece il caricatore della pinza rimane associato e il blocco della DNA polimerasi attiva la dissociazione di tutto il complesso, successivamente si va ad assemblare una nuova pinza ad un altro primer.