Nelle cellule tumorali, i recettori dei fattori di crescita risultano spesso sovraespressi, di conseguenza aumenta la loro sensibilità ai fattori di crescita, che ne stimolano la moltiplicazione, così da conferire un andamento clinico più aggressivo alla patologia.
Nelle cellule tumorali, i recettori dei fattori di crescita risultano spesso sovraespressi, di conseguenza aumenta la loro sensibilità ai fattori di crescita, che ne stimolano la moltiplicazione, così da conferire un andamento clinico più aggressivo alla patologia.
La presenza di un gran numero di recettori sulla superficie è legata a vari tipi di fenomeni tra cui l’amplificazione genica (cioè un aumento del numero copie del gene che può essere trascritto) oppure l’aumento di espressione sia attraverso mutazioni che colpiscono le zone regolatrici, o mutazioni che interessano proprio l’emivita dell’mRNA. Attraverso vari meccanismi (funzionali o strutturali) l’espressione del gene aumenta e si ha un aumento del numero di recettori.
In alcuni casi i recettori oltre a svolgere l’azione di legarsi al farmaco per favorirne l'ingresso nella cellula, sono il bersaglio vero e proprio dell’azione del farmaco.
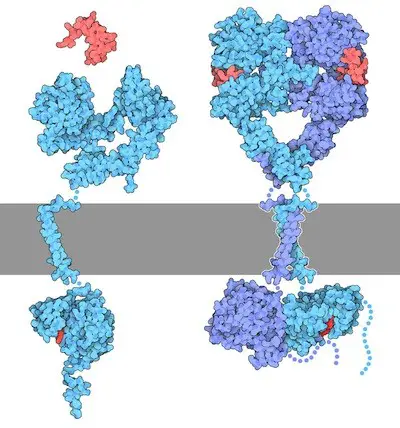
E’ il caso dei recettori della famiglia erbB, che sono recettori dell’EGF (Epidermal Growth factor) cioè dei fattori di crescita epiteliale, in particolare quelli della famiglia erbB. I bersagli farmacologici più studiati nei tumori solidi sono erbB1 (EGFR o HER1) e erbB2 (HER2/neu). Questi sono caratterizzati da un dominio intracellulare, uno trans-membrana ed uno extracellulare, tra i quali i domini fosfochinasici importanti per la funzione recettoriale. ErbB1 è una glicoproteina trans-membrana di 170 kD, che forma omo- ed etero-dimeri con altri membri della famiglia in seguito al legame con EGF o altri ligandi come TGF-α. ErbB2 è una tirosin-chinasi di 185 kD ancorata alla membrana cellulare. Sebbene non ne sia stato ancora identificato il ligando specifico, è noto che questa proteina è il partner preferenziale delle eterodimerizzazioni nell'ambito di tale famiglia.
Affinché il recettore venga attivato è necessario che si combinino domini chinasici due elementi: a questo punto il ligando può essere captato e mandato all’interno della cellula.
ErB1 viene attivato in seguito al legame con EGF, ma anche con TGF-α, che può essere rilasciato dalle cellule tumorali stesse che vanno a stimolare la divisione di altre cellule con un meccanismo autocrino.
I recettori dell’EGF sono un importante bersaglio farmacologico nella terapia anticancro,
soprattutto per i tumori di origine epiteliale, come quelli polmonari, mammari e al colon-retto. Sono stati sviluppati inibitori, come gefitinib e erlotinib, che agiscono direttamente sul dominio tirosin-chinasico inibendo la traduzione del segnale e anticorpi monoclonali, cetuximab e trastuzumab, diretti contro erB1 e erB2.
Il farmaco ottimale è quello che agisce selettivamente sulle cellule che sovraesprimono uno o più specifici recettori, per cui l'uso di questi farmaci è ristretto ai casi in cui quella specifica combinazione recettoriale è presente e che in genere è tipica per ciascuna forma di tumore.
Questo richiede che il tumore del paziente venga caratterizzato prima di utilizzare il farmaco preferenziale diretto a quel tipo di recettore che è più espresso sulla superficie delle cellule del colon o su quelle del polmone. I recettori sono il bersaglio diretto dell’azione del farmaco, cioè quest'ultimo non utilizza il recettore per penetrare nella cellula, ma è volto ad impedirgli di svolgere quella che è la sua funzione dannosa che sostiene la crescita tumorale.
Purtroppo però la terapia con gli inibitori della crescita è applicabile solo ad una percentuale relativamente modesta di pazienti con tumori che presentano caratteristiche precise, in cui si sono verificati gli eventi che hanno portato alla sovraespressione o all’amplificazione genica dei bersagli. Cioè se si ha un paziente con una diagnosi di tumore al colon si deve prima verificare che ci sia effettivamente un aumento del numero di recettori e che si possa trattare con il farmaco specifico. Tuttavia è possibile che la mutazione che ha portato alla sovraespressione del recettore sia tale da rendere il recettore, e il tumore, resistente all’azione dell’inibitore. Allora questo è un esempio di farmacogenetica del tumore: si deve caratterizzare geneticamente il tumore, non il paziente, per poter usare gli inibitori o gli anticorpi monoclonali più appropriati.
Per esempio,nel caso di una delezione degli esoni 2-7 che colpisce il gene EGFRvIII (ΔEGFR o del2-7EGFR), il dominio di legame con EGF è troncato, cioè il recettore ha perso la porzione che si deve legare al fattore di crescita per cui la cellula diventa indipendente dalla sua azione ed assume costitutivamente uno stato di attivazione per cui è resistente all’azione di questi farmaci. Al contrario gefinitib, trastuzumab ed altri inibitori dei fattori di crescita sono particolarmente indicati in presenza di mutazioni che interessano la porzione genica che codifica per l’RTK di EGFR. In questo caso si verifica l'effetto opposto, cioè la mutazione blocca la trasduzione del segnale e il farmaco inibisce efficacemente il legame con il fattore di crescita.
Un altro sistema sfrutta gli anticorpi monoclonali coniugati con agenti chemioterapici in modo da colpire selettivamente le cellule del tumore che esprimono sulla superficie antigeni specifici che possono interagire con l’anticorpo.
Il vantaggio rispetto agli altri farmaci antitumorali è che il trattamento è diretto specificamente contro le cellule tumorali, e non interessa le cellule sane del soggetto, come invece succede con i chemioterapici che agiscono con un meccanismo poco selettivo che colpisce tutte le cellule in attiva divisione.
Questi farmaci non sono solo in corso di studio, ma già in uso, e anche se allo stato attuale il loro impiego è ristretto a specifici casi, questa linea di sviluppo sembra molto promettente e con l'aumentare della capacità di caratterizzare le cellule tumorali sarà possibile disegnare strategie sempre più efficaci per colpire il bersaglio in modo più selettivo. Non solo la terapia del cancro diventa più mirata a colpire la cellula tumorale nella sua diversità, ma permette di agire anche sulle metastasi, se l’antigene che caratterizza la superficie cellulare del tumore primario è presente anche sulle cellule della metastasi, anche se non è detto perché le cellule neoplastiche continuano a cambiare anche le loro caratteristiche antigeniche.