1.- DISTRIBUCIÓN DE LA ENERGÍA RADIACTIVA EN LOS DIFERENTES COMPONENTES DE LA ENERGÍA MOLECULAR, La energía total de una molécula (E) se distribuye del siguiente modo:
E = Ee + (Eo + Er + Et)
Siendo: Ee la energía electrónica y Eo, Er y Et las energías cinéticas de oscilación, rotación y traslación molecular (energías térmicas). Los valores más elevados corresponden a la Ee. La energía media (E) para provocar una ionización en medio acuoso es de 32 eV.
2.- TRANSFERENCIA DE LA ENERGÍA RADIACTIVA A LOS COMPONENTES DE LA ENERGÍA MOLECULAR. ASPECTO CUANTITATIVO, La transferencia de energía en forma térmica no es suficiente para provocar lesiones moleculares. La transferencia de energía por ionización y excitación producen lesiones moleculares. En una ionización, parte de la energía perdida es transferida a la molécula que se convierte en un ión positivo y parte de la energía es arrastrada por el electrón que es liberado con energía cinética. En la excitación el electrón permanece en la molécula pero salta a un nivel más elevado. Las moléculas que han adquirido un exceso de energía por ionización o excitación son muy inestables. Este exceso se transfiere mediante:
– Emisión de un fotón (fenómeno de fluorescencia).
– Transferencia de energía a un enlace químico, provocando la rotura de dicho enlace, de esta forma se produce lesión molecular.
El número de moléculas que experimentan una ionización es elevado, una dosis de 1 Gy produce 2 x 1017 ionizaciones en 1 litro de agua. En un núcleo celular, cuya masa es de 10-10 gr., una dosis de 1 Gy produce 20.000 ionizaciones. Estas ionizaciones se distribuyen en las moléculas del núcleo llegando al ADN alrededor de 2.000 ionizaciones.
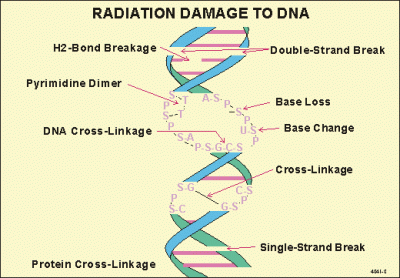
3.- LESIONES DEL ADN PRODUCIDAS POR LAS RADIACIONES IONIZANTES, Las lesiones del ADN pueden ser primarias o definitivas.
– Lesiones primarias: Son muy inestables y la mayoría son reparadas rápidamente y sin consecuencias.
– Lesiones definitivas: Son estables e irreversibles.
Las lesiones primarias del ADN son debidas a la transferencia directa de la energía radiactiva a la molécula, entonces se trataría de un efecto directo. También pueden ser secundarias a la inducción de reacciones fisicoquímicas complejas en el entorno inmediato del ADN, por ionización o excitación de las moléculas de H2O más próximas, entonces se trataría de un efecto indirecto.
3.1.- RADIOLISIS DEL H2O Y EFECTO INDIRECTO, La molécula de agua es descompuesta en dos radicales, cada uno de los cuales es portador de un electrón no apareado:
OH. y H.
Estos radicales son muy reactivos. Los productos de la radiolisis son diferentes de los producidos en la disociación electrolítica del agua en donde no existe ningún electrón desapareado (Por ejemplo: H2O+ sería agua ionizada).
3.2.- EFECTO DIRECTO SOBRE EL ADN, En el efecto directo, la lesión molecular se produce como resultado de la acción de un paquete de energía radiactiva muy localizado en una región sensible de la cadena de ADN. Estas regiones corresponden a un segmento muy corto de la cadena de ADN o a un nucleosoma. Entre las lesiones moleculares las más importantes son las lesiones secundarias a los paquetes de energía de densidad elevada.
3.3.- REPARACIÓN DE LAS LESIONES PRIMARIAS DEL ADN, En una célula de un mamífero, una irradiación de 1 Gy provoca alrededor de 1.500 roturas. Al cabo de unas horas, el número de roturas observadas es tan sólo de algunas decenas. Por consiguiente, la célula puede reparar en todo momento algunas lesiones del ADN. Esto es debido a la acción de las enzimas de reparación.
3.4.- MECANISMOS DE REPARACIÓN, Existen numerosos sistemas de reparación, algunos repararán de forma perfecta y otros de forma defectuosa, que pueden tener como consecuencia la aparición de mutaciones.
3.4.1.- ESCISIÓN DE UNA BASE Y RESÍNTESIS:
– Una Glucosilasa elimina la base deteriorada.
– Una Endonucleasa corta hebra dañada.
– Una Fosodiesterasa elimina el fosfato de la desoxirribosa correspondiente.
– Una ADN-Polimerasa permite la reconstrucción de la hebra lesionada tomando como modelo la hebra complementaria intacta.
3.4.2.- ESCISIÓN DE UN NUCLEÓTIDO Y RESÍNTESIS:
– Una parte de la hebra (zona lesionada) es eliminada por dos incisiones alrededor de la lesión.
– Reconstitución de la cadena tomando como modelo la hebra complementaria.
– Intervención de más de 13 enzimas diferentes.
3.4.3.- RECOMBINACIÓN HOMÓLOGA:
– Mecanismo para reparar roturas de las dos hebras.
– Intercambio entre una de las hebras no lesionada del gen paterno y una hebra de la cadena afectada del gen materno.
– Basado en la identidad de la secuencia de nucleótidos entre las copias paterna y materna de un mismo gen.
– Reparación exacta.
3.4.4.- RECOMBINACIÓN NO HOMÓLOGA O ILEGÍTIMA:
– Es la reparación rápida de las roturas de las dos hebras.
– Se efectúa a costa de una alteración de la cadena y/o de la pérdida de una parte de ésta.
– La reparación es incorrecta.
3.4.5.- REPARACIÓN DENOMINADA SOS:
– Solo interviene al fallar los demás mecanismos de reparación.
– No funciona de forma permanente.
– Permite sobrevivir a la célula, pero a costa de una reparación incorrecta.
– No demostrada su existencia en células de mamíferos.
3.5.- PATOLOGÍA HUMANA Y REPARACIÓN DEL ADN: En humanos existen determinadas enfermedades congénitas como el xeroderma pigmentoso, la ataxia telangiectásica o la anemia de Fanconi, en las cuales existen anomalías de la reparación del ADN. Estas enfermedades tienen diferentes manifestaciones clínicas, pero tienen en común que presentan una predisposición al cáncer. las enzimas de reparación son fundamentales para la supervivencia celular normal y para la conservación del patrimonio genético, ya que las moléculas de ADN son estructuras muy frágiles.
4.- LESIONES CROMOSÓMICAS INDUCIDAS POR LAS RADIACIONES EN LAS CÉLULAS DE LOS MAMÍFEROS. LESIONES DE LOS CROMOSOMAS: Las lesiones radioinducidas sobre el ADN no son observables ni siquiera con el mayor aumento existente en microscopía. Sin embargo sí es posible observar algunas indirectamente, son las “aberraciones cromosómicas”. Los cromosomas sólo son observables con microscopio óptico durante la metafase. El genoma humano esta formado por 46 cromosomas organizados en 22 pares de homólogos y un par de cromosomas sexuales X e Y. Existe una gran variedad de lesiones cromosómicas, entre las que distinguen las anomalías cromatídicas (lesiones de una sola cromátida) que aparecen si la lesión inicial ha sido tras la fase S del ciclo y las lesiones cromosómicas que aparecen si la lesión inicial fue antes de la fase S.
5.- CONTROL DEL CICLO CELULAR Y HOMEOSTASIA.
5.1.- HOMEOSTASIA: La homeostasia esta garantizada gracias al ciclo de división celular, que se activa o inhibe según las necesidades. En un tejido o conjunto de células desaparecen constantemente células por muerte natural (apoptosis) o por agresiones; esta perdida es compensada mediante la formación de nuevas células que mantienen la función de un determinado órgano a un ritmo estable (homeostasia).
5.2.- CONTROL DEL CICLO CELULAR: Las fases del ciclo celular son las siguientes:
Primero una fase de reposo Go. El paso de la fase Go a la fase G1 es desencadenada por factores de crecimiento o citocinas. El ciclo celular está controlado por numerosos factores que pueden activarlo o detenerlo. los factores son complejos proteicos que se asocian a unas enzimas, las cinasas, las cuales se unen a las ciclinas, que son específicas para cada fase del ciclo. En los puntos de paso de la fase G1 a la S se verifica que el ADN no este dañado y así poder replicarlos en los puntos de la fase G2 a la fase M donde se verifica la integridad de los cromosomas replicados. El paso de una fase del ciclo a otra también puede retardarse para que las enzimas de reparación del ADN tengan el tiempo necesario para restablecer la integridad del genoma.
5.3.- PROTOONCOGENES Y GENES SUPRESORES DE TUMORES: Algunos genes están estrechamente relacionados en el control o ausencia de regulación del ciclo celular. Si los protooncogenes se activan para actuar como oncogenes, aumentan el ritmo de división celular y pueden causar un cáncer. Sin embargo, los antioncogenes o genes supresores de tumores tienen la función de frenar el ciclo celular. dentro de los antioncogenes destaca el gen p53 que produce una proteína que se fija sobre las secuencias reguladoras del ADN. El p53 también puede retrasar o parar el ciclo celular para favorecer la reparación del ADN. Si no hay una perfecta reparación, la p53 puede provocar en la célula una muerte programada o apoptosis y así controlar la división celular. Una mutación de este gen conllevaría a la consecución de cánceres y metástasis. Las radiaciones ionizantes son capaces de provocar la aparición de mutaciones en el gen p53.
6.- INFLUENCIA DE LA IRRADIACIÓN SOBRE EL CONTROL DEL CICLO CELULAR, Los efectos de las irradiaciones sobre el control del ciclo celular son múltiples. Algunos son nefastos, como la mutación del gen p53 o la activación de protooncogenes o factores de crecimiento. Sin embargo, también hay otros favorables como la activación del gen p53 y los bloqueos en las fases G1 y G2 del ciclo celular, que favorecen la reparación de las lesiones del ADN.
7.- CONCEPTO DE APOPTOSIS: Es un tipo de muerte celular que difiere de las necrosis celulares producidas por un agente químico o físico. La apoptosis es un fenómeno natural que cada célula contiene en su genoma. La apoptosis permite la existencia de la homeostasia. El equilibrio entre células de nueva creación y las que desaparecen por apoptosis permiten conservar un volumen constante del órgano o tejido. Este equilibrio puede ser alterado por la irradiación y suprimir la apoptosis natural, quedando la célula inmortalizada y pudiendo causar un cáncer o al contrario, provocar la muerte celular prematura, apoptosis radioinducida.
8.- APOPTOSIS RADIOINDUCIDA: Mediante técnicas de biología molecular se puede hacer el marcaje in situ de células que está en apoptosis. Para ello se usan marcadores específicos que se fijan a los extremos del ADN. también se puede precisar el tipo de célula que se encuentra en apoptosis y determinar el porcentaje de células afectadas.
9.- ASPECTOS CUANTITATIVOS: La proporción de células supervivientes para una dosis dada depende en gran medida del tipo celular irradiado. Hay células bacterianas que resisten dosis de 10.000 Gy y que sobreviven en las piscinas de refrigeración y en las barras de uranio de los reactores nucleares. La muerte celular por irradiación puede considerarse un fenómeno aleatorio, sometido a las leyes del azar y probablemente por lesiones del genoma. Cuando las dosis son bajas, las lesiones primarias del ADN o la mayor parte de ellas pueden ser reparadas por enzimas específicas de las células. Cuando la dosis aumenta, se supera la capacidad enzimática y aparece el efecto. una dosis de 4-5 Gy al cuerpo humano durante 1 seg. es mortal en el 50% de los casos; mientras que esa misma dosis durante varios años no afecta a la supervivencia. La eficacia de las radiaciones ionizantes de provocar lesiones viene determinada por la eficacia biológica relativa. La radiación que se toma de referencia es la producida por una lámpara de Rayos X de 200 Kv. Una misma radiación puede tener diferente EBR según sea el efecto producido (muerte celular, mutación). La EBR es más elevada cuanto mayor es la TLE.
10.- LEY DE BERGONIÉ-TRIBONDEAU, “Las células más radiosensibles son las menos diferenciadas, las más activamente mitóticas y las que sufrirán más divisiones en el futuro”. En orden creciente de radiosensibilidad: neuronas < músculo < hueso y hematíes < glándulas salivares, páncreas, hígado, riñón y tiroides < endotelio, fibroblastos y cartílago de crecimiento < piel < espermatocitos y oocitos < espermatogonias < epitelio tubo digestivo < tejido hematopoyético < linfocitos.
11.- IMPORTANCIA DEL “RUIDO DE FONDO” DE LAS MUTACIONES NATURALES, El número de mutaciones naturales es importante. El número de genes en el genoma humano está entre 50.000 y 100.000, de ahí que el porcentaje de células portadoras de una mutación natural sea del 5-50%. Con lo cual, “el ruido de fondo” de las mutaciones naturales es considerable y se cree que la mitad de los abortos espontáneos es por una anomalía genética.
12.- EXPRESIÓN DE LAS MUTACIONES: H. J. Muller demostró que las radiaciones ionizantes producen mutaciones en la descendencia de los individuos irradiados. La frecuencia de las mutaciones aumenta un 1% por cada aumento de 10 Gy en la dosis.
13.- MUTACIÓN DE LOS GENES: Un cáncer radioinducido es consecuencia de la mutación de uno o varios genes, modificando sus funciones. Los genes implicados en los mecanismos de la carcinogénesis se clasifican en dos variedades: los oncogenes y los genes supresores de tumores o antioncogenes.
– ONCOGENES: Favorecen la aparición de cáncer. No existen en el estado normal de la célula, pero provienen de protooncogenes que pueden ser activados. Las radiaciones ionizantes se encuentran entre los agentes que pueden inducir la activación de los oncogenes.
– GENES SUPRESORES DE TUMOR (ANTIONCOGENES): Se encuentran en todas las células normales y son indispensables para el buen funcionamiento celular. Controlan el ciclo celular y regulan la capacidad de proliferación de la célula. La mutación o pérdida de función de un antioncogen favorece la aparición de tumores.
– GENES SUPRESORES DE TUMOR (ANTIONCOGENES): El gen p53 es un gen supresor de tumores y se localiza en el cromosoma 17. Desempeña un papel fundamental en la represión del ciclo celular. Al bloquear el ciclo celular en la fase G1, permite que la célula lleve a cabo una mejor reparación del ADN antes de su paso a la fase S. cuando las lesiones son muy numerosas, el gen p53 también puede orientar a la célula dañada hacia la muerte programada o apoptosis, evitando que entre en mitosis. Este gen aparece mutad.