Enzima – Struttura molecolare di natura proteica che negli organismi viventi svolge la funzione di catalizzatore biologico, ossia di sostanza capace di accelerare il decorso di una reazione chimica. Il termine enzima è stato coniato nel 1897 dal fisiologo tedesco Wilhelm Kühne (1837-1900) e deriva dal greco en, "dentro", e zymé, "lievito".
Enzima – Struttura molecolare di natura proteica che negli organismi viventi svolge la funzione di catalizzatore biologico, ossia di sostanza capace di accelerare il decorso di una reazione chimica. Il termine enzima è stato coniato nel 1897 dal fisiologo tedesco Wilhelm Kühne (1837-1900) e deriva dal greco en, "dentro", e zymé, "lievito". Lo studio delle proprietà degli enzimi è di competenza della biochimica; i progressi nella conoscenza di queste molecole hanno permesso rilevanti applicazioni soprattutto nella biologia molecolare, nell’ingegneria genetica e nella medicina (ad esempio, si può citare l’impiego della DNA polimerasi nel processo noto come reazione a catena della polimerasi).
Gli enzimi sono formati da molecole proteiche ripiegate in modo da assumere una conformazione nello spazio (o struttura terziaria della proteina) che è tipica di ciascun enzima. Alcuni enzimi, detti coniugati possiedono, legato alla catena proteica che prende il nome di apoenzima, un fattore o coenzima, fattore che ha la funzione di facilitare l'azione enzimatica. Il coenzima può consistere in un semplice ione (ad esempio, di magnesio, di ferro, di manganese, di cobalto o di zinco), in una vitamina, oppure può essere rappresentato da una molecola più complessa, e in tal caso viene detto cofattore (sono ad esempio importanti cofattori il nicotinamide-adenin-dinucleotide, NAD, e il flavin-adenin-dinucleotide, FAD, coinvolti nelle reazioni della respirazione cellulare).
La capacità di un enzima di rendere più veloce una reazione chimica viene detto potere catalitico, e corrisponde a un fattore di almeno 106: ciò significa che la reazione viene accelerata di un milione di volte. È importante osservare che l’equilibrio di reazione, invece, non viene modificato: se all’equilibrio la concentrazione del prodotto è 10 volte quella del reagente, tale rapporto non cambia anche in presenza del catalizzatore enzimatico, che rende più rapido il raggiungimento del punto di equilibrio.
L’attività di un enzima è altamente specifica per il tipo di reazione che esso catalizza e per il tipo di reagenti (o substrato) che intervengono nella reazione stessa. In base al tipo di reazione che catalizzano, si possono distinguere differenti classi di enzimi: in particolare, gli enzimi idrolitici intervengono nelle reazioni in cui una sostanza viene degradata in composti più semplici, in presenza di acqua; gli enzimi ossidanti, o ossidasi, catalizzano le reazioni di ossidazione; gli enzimi riduttori, o riduttasi, agiscono invece nelle reazioni di riduzione, in cui viene eliminato ossigeno. Il nome di un enzima si forma aggiungendo il suffisso -asi al nome del substrato con cui reagisce: secondo tale convenzione, ad esempio, l'enzima che controlla la scomposizione dell'urea si chiama ureasi, mentre quelli che controllano l'idrolisi delle proteine vengono detti proteasi (fanno eccezione alcuni enzimi, come la tripsina e la pepsina, che mantengono il nome che avevano prima dell'adozione di questa nomenclatura). Alcuni enzimi possiedono una proprietà particolare, che prende il nome di autocatalisi: essi, cioè, inducono la loro stessa formazione a partire da un precursore inerte chiamato zimogeno. In virtù di questa proprietà, tali enzimi possono essere facilmente fabbricati in provetta.
La funzione di catalisi di un enzima consiste nella riduzione dell’energia di attivazione richiesta da una data reazione chimica se non intervenisse alcun catalizzatore. Perché un reagente (o substrato), caratterizzato da una certa quantità di energia libera G, si trasformi nel prodotto, deve acquisire una certa quantità di energia (energia di attivazione) e passare attraverso uno stadio energeticamente superiore a quello iniziale (stato di transizione). In questo stato, le molecole si agitano più velocemente e più facilmente collidono tra loro. Se si aumenta la temperatura del reagente, poiché questa aumenta l’energia cinetica molecolare, aumenterà proporzionalmente il numero di molecole che raggiungono lo stato di transizione e che possono interagire, e la reazione decorrerà più rapidamente.
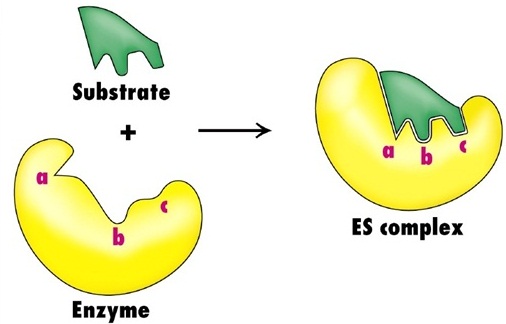
I sistemi biologici, però, non tollerano elevati aumenti di temperatura; la velocità delle reazioni viene allora accelerata in altro modo, ovvero diminuendo la quantità di energia di attivazione richiesta dal reagente. In altri termini, un enzima non favorisce la collisione tra molecole di reagente apportando energia, ma facilitando fisicamente la loro interazione; a tale scopo lega le molecole del reagente in uno specifico sito della sua struttura tridimensionale, detto sito attivo che, conformato come una sorta di tasca, si adatta perfettamente al substrato.
Il legame nel sito attivo tra i reagenti e l'enzima è possibile grazie alla complementarietà che sussiste tra la struttura dell'enzima e quella dei reagenti stessi. La corrispondenza tra le molecole è talmente precisa che il legame tra l'enzima e i reagenti viene solitamente paragonato al legame tra una chiave e la serratura corrispondente. Il riconoscimento tra le molecole di reagente e quelle di enzima prende il nome di interazione stereo-specifica e porta alla formazione del cosiddetto complesso enzima-substrato (E-S), in cui si verifica una modificazione della conformazione della molecola enzimatica tale da avvicinare i reagenti a essa legati e da favorirne l'interazione. Le molecole di reagente a questo punto reagiscono tra loro; si formano le molecole dei prodotti di reazione; infine, il complesso enzima-substrato si scinde. Gli enzimi, avvenuta la reazione, non vengono consumati e possono intervenire a catalizzare una nuova reazione chimica.
Molti enzimi si comportano in modo tale che, se la concentrazione del substrato S è bassa, la velocità di catalisi V è proporzionale a questa; quando invece la concentrazione del substrato aumenta notevolmente, la velocità diviene praticamente indipendente.
Questo comportamento prende il nome di cinetica di Michaelis-Menten, dal nome di Leonor Michaelis e Maud Menten che ne formularono il modello nel 1913. Secondo questo modello, un enzima E si combina con il substrato S e forma inizialmente un intermedio E-S; quindi E si libera e dà luogo al prodotto P. Il complesso E-S si forma secondo una costante k1; può però dissociarsi formando nuovamente E + S secondo una costante k2 oppure formare E + P secondo una costante k3. Il passaggio che determina la velocità di reazione è quello che porta da E-S a E + P. In base al modello di Michaelis-Menten, la velocità della reazione enzimatica è data da V = k3 ES.
Gli enzimi sono straordinariamente efficienti: quantità minime di un enzima possono ottenere a basse temperature ciò che, con mezzi chimici ordinari, richiederebbe reagenti estremamente potenti e temperature molto elevate. Ad esempio, circa 30 g di pepsina pura allo stato cristallino possono digerire quasi 2 t di albume in poche ore. La cinetica delle reazioni enzimatiche si differenzia da quella delle reazioni chimiche semplici: ogni enzima è specifico rispetto alla sostanza in cui produce la reazione e ha la massima efficacia a una precisa temperatura. Anche se un aumento del calore può determinare l'accelerazione di una reazione, gli enzimi sono molecole instabili che non sopportano ampie variazioni di temperatura. L'attività catalitica di un enzima è determinata soprattutto dalla sua sequenza amminoacidica e dalla sua struttura terziaria (cioè tridimensionale e ripiegata).