Gli Anticorpi sono grandi proteine A Y che risultano essere reclutati dal sistema immunitario (SI) per identificare ed in seguito neutralizzare gli oggetti non Xeros come i batteri ed i virus.
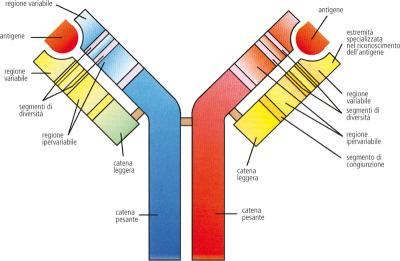
Gli anticorpi abbondanti nel sangue sono strutture globulari, tetrameri formati da 4 catene polipeptidiche uguali a 2 a 2, due leggere perché più corte e due pesanti più lunghe.
Gli Anticorpi sono grandi proteine A Y che risultano essere reclutati dal sistema immunitario (SI) per identificare ed in seguito neutralizzare gli oggetti non Xeros come i batteri ed i virus.
Gli anticorpi abbondanti nel sangue sono strutture globulari, tetrameri formati da 4 catene polipeptidiche uguali a 2 a 2, due leggere perché più corte e due pesanti più lunghe.
Sia nelle catene pesanti che in quelle leggere si hanno domini con una caratteristica particolare, sono regioni a foglietti-β sovrapposti, 2 in ogni catena leggera e 4 per ogni catena pesante.
Presenta ponti disolfuro sia intercatenali che intracatenali; tra i foglietti-B che formano il dominio ci sono ponti disolfuro che stabilizzano la proteina, le zone diverse in diversi anticorpi sono nei domini terminali dei bracci della Y. Gli anticorpi sono glicoproteine ed hanno catene oligosaccaridiche legate a serine o asparagine del dominio 3 delle catene pesanti, un gruppo per catena, che conferisce proprietà caratteristiche agli anticorpi.
La CDR è la regione che lega l'antigene, gli aminoacidi che si affacciano a quelle estremità danno i gruppi per l'interazione con l'antigene, la reazione antigene-anticorpo è molto specifica.
La parte costante delle catene pesanti serve per funzioni effettrici quali il legarsi a specifici recettori cellulari o attivare una cascata enzimatica come la cascata del complemento, funzioni per eliminare la molecola estranea. Il legame dei gruppi oligosaccaridici alle proteine rientrano tra le modificazioni post-traduzionali delle proteine e avviene nel reticolo endoplasmatico.
Il Siero contenente gli anticorpi antigene-specifici è chiamato antisiero. Ci sono cinque classi di immunoglobuline (Ig) compreso IgM, IgG, IgA, IgD e IgE.
Funzioni dell'Anticorpo: Le legature dell'anticorpo agli antigeni specifici.
Ciò segnala le altre celle del sistema immunitario per liberarsi dei microbi d'invasione. La concentrazione dell'associazione fra l'anticorpo ed un antigene ad una singola sede del legame è conosciuta come l'affinità dell'anticorpo per l'antigene. L'affinità fra l'anticorpo e la sede del legame dell'antigene è determinata dal tipo di obbligazione formato. Poiché un antigene può avere epitopi differenti di multiplo, una serie di anticorpi possono legarsi alla proteina.