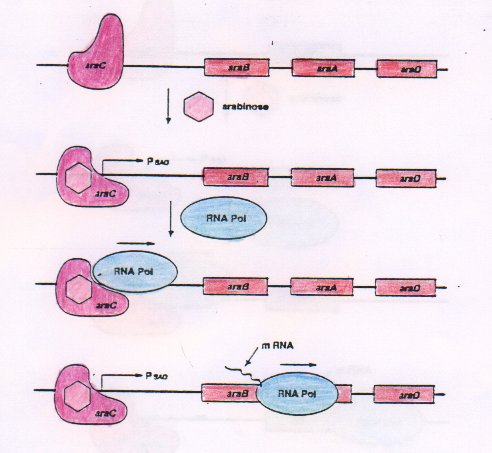
La proteina inibitrice è formata da due domini: uno N-terminale che presenta una tasca di legame per l'arabinosio ed è capace di interagire con domini uguali; uno C-terminale capace di interagire con il DNA.
In assenza di arabinosio i domini C-terminali riconoscono i siti specifici di legame sul DNA (O2 e I1) e il dominio N-terminale dimerizza, unendosi al dominio N-terminale di un altro dimero; il DNA forma un'ansa e la trascrizione è repressa.
La proteina inibitrice è formata da due domini: uno N-terminale che presenta una tasca di legame per l'arabinosio ed è capace di interagire con domini uguali; uno C-terminale capace di interagire con il DNA.
In assenza di arabinosio i domini C-terminali riconoscono i siti specifici di legame sul DNA (O2 e I1) e il dominio N-terminale dimerizza, unendosi al dominio N-terminale di un altro dimero; il DNA forma un'ansa e la trascrizione è repressa.
Se l'arabinosio è presente si lega al sito specifico del dominio N-terminale della proteina, ciò induce un cambiamento in tutta la proteina per cui i domini non interagiscono più formando il ponte, ma il dominio C-terminale che prima interagiva con il sito O2 si lega al sito I2 del DNA permettendo la trascrizione dell'operone.