I farmaci xenobiotici
L’organismo ha la capacità di agire su molecole xenobiotiche, le molecole estranee all’organismo stesso (i farmaci sono xenobiotici per eccellenza), operando reazioni chimiche idonee a cambiare strutturalmente lo xenobiotico stesso.
La biotrasformazione dei farmaci
Questa capacità, detta biotrasformazione dei farmaci o metabolismo dei farmaci, vede impegnati molti enzimi e proteine che si sono evoluti in una vasta gamma quasi totipotente, la capacità di biotrasformazione di questi enzimi riguarda molecole che la natura non contempla; abbiamo sviluppato una capacità ampia da variare la struttura chimica di composti inediti nell’organismo.
Il metabolismo degli xenobiotici ha una funzione difensiva, è una difesa che l’organismo mette in atto nei confronti di composti potenzialmente tossici.
La continua capacità adattativa dei vari organismi e specie, ha portato allo sviluppo di una miriade di composti strutturalmente molto diversi, dal punto di vista dei vegetali; dalla parte degli animali, invece, ha portato alla capacità di elaborare tutta una serie di sistemi biotrasformativi in grado di neutralizzare e rendere queste molecole eliminabili il più in fretta possibile.
La biotrasformazione tende a detossificare e a rendere la molecola più velocemente eliminabile, rendendola più idrofila.
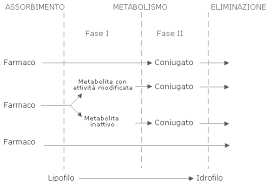
Tipicamente una reazione di biotrasformazione è una reazione che fa si che una data molecola, uno xenobiotico, diventi qualcos’altro. Un farmaco che viene trasformato diventando un metabolita che perde l’attività farmacologica si definisce molecola genitore, da cui originano metaboliti inattivi.
La cessazione dell’attività del farmaco
La cessazione dell’attività del farmaco, è legato alla fase di scomparsa del farmaco dall’organismo e al metabolismo; allo scemare della presenza del farmaco nell’organismo scema anche l’attività farmacologica.
Altra possibilità è che il farmaco subisca la reazione di biotrasformazione, ma il metabolita resta attivo. Quindi osservando la curva della concentrazione plasmatica del farmaco, vediamo che il farmaco iniziale va a scemare ma l’attività farmacologica non cala perché viene mantenuta dal metabolita che si forma che ne prolunga l’emivita dell’attività.
Altra possibilità che osserviamo e la strategia di profarmaco, la molecola che viene somministrata non è farmacologicamente attiva, è un composto inerte che, in seguito a una reazione di biotrasformazione, viene trasformata dal punto di vista strutturale portando a un metabolita attivo.
Categorie di biotrasformazione dei farmaci
Tradizionalmente si distinguono due grosse categorie di reazioni chimiche di biotrasformazione:
- reazioni di fase I: si possono definire anche reazioni di funzionalizzazione
- reazioni di fase II: si possono definire anche reazioni di coniugazione
completamente indipendenti. Uno xenobiotico immesso nell’organismo può dare modo ad entrambe le fasi.
Da un solo composto si possono avere molti potenziali metaboliti strutturalmente differenti.
Le reazioni chimiche di fase I
Le reazioni di fase I o funzionalizzazione, sono reazioni in cui determinati enzimi o sistemi enzimatici dell’organismo vanno a operare sul composto xenobiotico, reazioni tali da portare alla esibizione di gruppi funzionali che ne incrementano la polarità e che sono idonei anche per reazioni di coniugazione; tali gruppi sono quello ossidrilico, composti carbonilici come aldeidi, composti carbossilici, gruppi amminici liberi o parzialmente liberi, gruppi tiolici. Le principali reazioni di funzionalizzazione sono: reazioni di idrolisi e ossidazione; in modo molto meno rilevante si operano reazioni di riduzione.
Le reazioni di fase II
Nelle reazioni di coniugazione, di fase II, l’organismo mette a disposizione delle molecole endogene come l’acido acetico, come il glutatione, come l’acido glucuronico, come l’acido solforico; molecole, quindi, che l’organismo va a legare allo xenobiotico purché presenti opportuni gruppi funzionali che sono, per esempio, quelli che esprime un composto dopo la fase I.
L’idrolisi
Nelle reazioni di fase I come quelle idrolitiche è necessario che il composto, per subire un’idrolisi, possieda determinate caratteristiche. L’idrolisi è un fenomeno di biotrasformazione che riguarda composti come le ammidi, che hanno una relativa capacità di essere idrolizzate, ma in modo ancora più eclatante, ad opera di enzimi come le esterasi, abbiamo l’idrolisi degli esteri; queste reazioni di idrolisi portano allo smascheramento di gruppi funzionali utili, infatti da un estere o da un’ammide ottengo lo smascheramento di due gruppi polari. Sono reazioni a opera di enzimi specifici che hanno una relativa selettività di intervento.
Le reazioni di ossidazione, invece, sono quelle di gran lunga più importanti nel metabolismo di fase I. Queste vengono svolte a opera di due principali categorie di enzimi ossidativi: enzimi microsomiali o sistema ossidativo microsomiale e un sistema non microsomiale.
Sistema microsomiale
Per sistema microsomiale si intende tutta una serie di proteine ad azione enzimatica presenti nei microsomi (questi derivano da processi di centrifugazione progressiva degli strati cellulari), le membrane del reticolo endoplasmatico. In queste membrane osserviamo una serie di proteine tra cui una vasta espressione di citocromi P450.
Funzione del sistema del citocromo P450
Il principale responsabile delle reazioni ossidative microsomiali è il sistema del citocromo P450. Per funzionare, questa proteina ha bisogno della collaborazione di altre proteine. Il suddetto citocromo è responsabile di reazioni di tipo ossidativo, è una ossidasi a funzione mista in grado di ossidare in modo aspecifico una serie di composti (abbiamo un centinaio di possibili proteine differenti facenti parte della vasta classe dei citocromi P450). Anche questa diversità di isoforme conferisce al sistema la grande capacità di adattamento e quindi l’idoneità a ossidare pressoché tutti gli xenobiotici esistenti.
Il sistema non microsomiale e i farmaci xenobiotici
Questa è una caratteristica che differenzia il sistema microsomiale ossidativo dai sistemi non microsomiali. Quelli non microsomiali sono rappresentati da enzimi ossidativi che hanno una notevole selettività di azione, riconoscono solo determinati substrati e solo su essi possono agire; infatti i sistemi non microsomiali hanno una potenzialità biotrasformativa nei confronti degli xenobiotici molto meno spiccata.
Il citocromo P450 è caratterizzato dalla presenza di un gruppo eme, quindi un sistema tetrapirrolico che va a tenere bloccato un atomo di Fe3+.
Il citocromo si chiama P450 per il fatto che quando l’atomo di ferro viene complessato con il monossido di carbonio tutte queste proteine assorbono a 450 nanometri. Attualmente la nomenclatura che vedrete applicata al citocromo P450, vede un’abbreviazione di questo tipo: CYP, numero-lettera-numero.
Abbiamo quindi un sistema ternario in cui la prima cifra indica la famiglia, la seconda cifra indica la sottofamiglia, infine, l’ultimo indica la vera e propria isoforma.
I citocromi
I citocromi più importanti sono:
- CYP-2C6
- CYP-2C9
- CYP-2A2
- CYP-3A4
Il citocromo P450 fa parte di un sistema enzimatico; è solo uno dei componenti del processo di biotrasformazione che definiamo ossidazione microsomiale, è protagonista ma da solo non basta. Il citocromo P450 infatti possiede, in prossimità del gruppo prostetico, una tasca in grado di ospitare lo xenobiotico.
Sequenza dell’ossidazione microsomiale
L’ossidazione avviene con questa sequenza:
- quando un gruppo xenobiotico genericamente indicato con RH viene ospitato all’interno si forma un complesso che diventa substrato di una reduttasi NADPH-dipendente (CYP-450 reduttasi); quindi abbiamo una riduzione a carico dell’atomo di ferro. Abbiamo uno stato transitorio in cui il sistema vede il suo atomo di ferro ridotto come Fe2+.
- A questo punto il citocromo accoglie anche una molecola di ossigeno, quindi il complesso si allarga ulteriormente e abbiamo un sistema in cui il citocromo con Fe2+ è legato sia allo xenobiotico sia alla molecola di ossigeno.
- Ancora una volta a opera di un ulteriore supporto esterno (si pensa CY-B5 reduttasi), un altro enzima in grado di donare elettroni con un processo NADH dipendente, si ha una ulteriore riduzione del sistema, che porta alla liberazione di acqua, del prodotto ossidato e al ritorno del citocromo alla sua forma originaria.
Sostanzialmente è la molecola di ossigeno che va a far si che uno dei suoi atomi venga regalato al substrato (un altro andrà via come come acqua), il citocromo catalizza questo passaggio ma per fare questo ciclo, ha necessità dell’intervento di due enzimi reduttasici che sono: CYP450 reduttasi e CYB5 reduttasi. Se non ci fossero questi enzimi, il citocromo sarebbe inerte. Finito il ciclo abbiamo il ritorno del citocromo P450 alla sua fase iniziale, pronto a ricominciare il giro.
In alcuni casi abbiamo, data la presenza di enzimi riducenti, anche la partecipazione di questo sistema a reazioni che sono sostanzialmente anomale: questo sistema, intrinsecamente, è capace di ridursi oltre che a ossidarsi.
Il citocromo P450 è in grado di svolgere reazioni ossidative tipo:
- Ossidazione alifatica; catene alifatiche possono essere ossidate con l’inserimento di gruppi OH in posizione primaria o secondaria, e tale ossidazione può essere spinta oltre andando a composti aldeidici, citocromici e carbossilici.
- Ossidazione aromatica, inserimento di gruppi OH su anelli aromatici;
il derivato che si forma è un epossido, che spontaneamente si trasforma in un composto fenolico. In altri casi l’epossido è più stabile. L’epossido idrolasi agisce sul gruppo formando un diolo.
- N,S-ossidazione (solfoni/solfossidi) il meccanismo è lo stesso, inserimento di atomi di ossigeno;
- reazioni di N,O,S-delachilazione; reazioni di alchilazione in cui viene rimosso un piccolo gruppo alchilico (metile o etile) legato precedentemente a un azoto/ossigeno/zolfo (X).
R-X-CH3 → R-X-H
Le esterasi sono enzimi ampiamente rappresentati, alcuni (aspecifici) sono anche circolanti nel plasma.
Intossicazione con composti acidi, la soluzione è il bicarbonato. Perchè?
In caso di intossicazione con composti acidi è indicata la somministrazione endovenosa di bicarbonato di sodio. Perché? Il bicarbonato è una base che, alcalinizzando il plasma, provoca una diuresi alcalina, in ambiente alcalino si ha maggiore dissociazione dell’acido debole, che viene riassorbito in maniera minore (aumentandone la clearance).
Metabolismo degli alcooli: gli alcooli, in particolare quelli primari (R-CH2OH), vengono ossidati in sistemi citosolici epatici e non microsomiali. L’enzima responsabile è detto alcool-deidrogenasi, che ossida l’alcool ad aldeide; l’aldeide-deidrogenasi converte il prodotto formato nell’acido carbossilico corrispondente.
R-CH2OH → R-CHO → R-COOH
Nei soggetti dediti ad un uso cronico di alcool si ha lo sviluppo di un sistema ossidativo microsomiale. Questo sistema è soggetto di un intervento per la terapia dell’alcolismo: infatti farmaci come il disulfiram inibiscono selettivamente l’aldeide-deidrogenasi, facendo aumentare il metabolita aldeidico, responsabile degli effetti avversi dell’alcool.
Le reazioni chimiche di fase II
Queste reazioni prevedono l’unione di uno xenobiotico ad una porzione molecolare fornita dall’organismo.
Glucuronazione
L’acido glucuronico interagisce con un vastissimo numero di molecole, tutte con un gruppo nucleofilo, quali: R-OH; R-NH(2); R-SH; R-COOH; da questa reazione si formano i glucuronidi.
Questa reazione avviene ad opera di una UDP-glucuroniltransferasi, presente in varie isoforme, che reagiscono con i composti più disparati.
Si ha l’attacco nucleofilo sul C1 dell’acido glucuronico, con inversione di configurazione (α→β), e si libera UDP difosfato. I derivati che si formano sono eteri, esteri, tioesteri o amminozuccheri. La presenza del glucuronide conferisce un’elevata idrofilicità, quindi una più facile escrezione con le urine. Talvolta, se il gruppo R è ingombrante e particolarmente lipofilo, i glucuronidi corrispondenti possono essere escreti a livello biliare. Però a livello della flora intestinale si hanno β-glucuronidasi batteriche che idrolizzano il legame con il glucuronidi, permettendo allo xenobiotico, libero, di essere riassorbito.
Coniugazione con acido acetico
Si effettua per aniline, idrazine, idrazidi e solfonammidi. Un’acetiltransferasi preleva il gruppo acetilico dall’AcetilCoA e lo trasferisce sul gruppo azotato. Anomalie genetiche a carico di questa reazione possono portare a intolleranze per determinati farmaci.
Solfatazione
Reazione utile per la neutralizzazione di gruppi fenolici
Coniugazione con glutatione
Reazione utile per l’eliminazione di gruppi elettrofili. Il glutatione è un tripeptide con una forte azione antiossidante. In forma ridotta funge da substrato endogeno, in quanto il gruppo solfidrilico (nucleofilo) può interagire con porzioni elettrofile delle molecole d’interesse (per esempio epossidi).
Metabolismo del paracetamolo
Il metabolita di fase I del paracetamolo viene neutralizzato dalla reazione con il glutatione; diventa tossico solamente se overdosato perché si esauriscono le scorte di glutatione per la coniugazione. Per impedire gli effetti tossici si somministra cisteina, che serve all’organismo per ripristinare le scorte di glutatione.
Laddove si osserva una risposta diminuita al farmaco si ha anche una necessità di aumentarne le dosi. Se la diminuita risposta è dovuta al metabolismo si parla di tolleranza farmacodinamica; questa è crociata nei confronti di tutti gli altri farmaci che utilizzano lo stesso meccanismo d’azione. Invece i sistemi di metabolismo dei farmaci possono indurre una tolleranza farmacocinetica, CYP450 per la faseI e la glucuronazione per la faseII possono portare a un effetto chiamato induzione enzimatica.
Induzione enzimatica dei farmaci
Alcuni farmaci si definiscono induttori enzimatici in quanto portano ad un potenziamento dell’attività enzimatica provocandone la sovraespressione. Il meccanismo riguarda un’azione a livello genomico, analoga ai recettori degli ormoni steroidei; infatti esistono recettori AH (idrocarburi aromatici) aspecifici che legano gli xenobiotici e il messaggio arriva nel nucleo, a determinate sequenze responsive su geni che codificano per enzimi farmaco-metabolizzanti.
L’induzione enzimatica determina una variazione della curva di assorbimento/eliminazione; ciò causa una ridotta efficacia o addirittura l’inefficacia del farmaco. Il “fallimento” non si ha solo per il farmaco che determina induzione ma per tutti i farmaci che condividono l’enzima (pattern metabolico).
La tolleranza farmacodinamica è crociata, vale per tutti i farmaci della stessa categoria farmacologica; la tolleranza farmacocinetica non dà questi problemi, si può da un altro farmaco con uguale meccanismo e diversa via metabolica.
Se l’induzione enzimatica è data da un profarmaco si ha un aumento della curva cinetica, che potrebbe concretizzarsi anche in un andamento simile a quello di un’overdose.
Assumendo un farmaco contemporaneamente ad un inibitore del sistema metabolizzante si ha un potenziamento dell’attività del farmaco; ugualmente si ha una inibizione del profarmaco se assunto con un inibitore enzimatico.
Reazioni anomale ai farmaci
Alterazioni o anomalie a carico di sistemi preposti al metabolismo dei farmaci sono responsabili dell’insorgenza di reazioni anomale ai farmaci. In generale alterazioni del profilo metabolico sono normali in relazione all’età (e in misura minore al sesso); il metabolismo dei farmaci nella prima infanzia è un meccanismo deficitario, la piena maturazione avviene tardivamente; nell’adulto si ha la massima capacità metabolizzante, che si riduce in senescenza.
Apnea da succinilcolina: farmaco con un’emivita molto breve, idrolizzato dalle esterasi aspecifiche. Alcuni pazienti, sospesa la succinilcolina, risentono anche per ore degli effetti del farmaco, ormai non più in circolo; ciò è legato al fatto che questi pazienti sono deficitari della capacità idrolitica dell’acetilcolinesterasi plasmatica.
Le persone sono divise in acetilatori rapidi (maggior parte) e lenti, in cui i prodotti, prima di essere acetilati, seguono altri metabolismi (potenzialmente tossici).
I passaggi sono divisi in due fasi:
- Reazioni di FASE I: Reazioni di attivazione del farmaco in senso chimico on quanto vengono aggiunti gruppi reattivi in farmaci che in genere sono lipofili; questi gruppi permettono una più facile eliminazione della sostanza.
Quando lo scopo è quello di aumentare la reattività chimica in modo che possono andare in contro a reazioni di fase II. - Reazioni di FASE II: comprendono coniugazioni con vari substrati che ne facilitano l’eliminazione.
A seconda delle varie vie di somministrazione, il farmaco attraversa diverse barriere (es. barriera gastrica, barriera intestinale), questa fase caratterizza l’assorbimento che cambia a seconda della proprietà delle sostanze ma anche a seconda dei recettori compatibili. Dopo questa fase abbiamo le reazioni di FASE I che aumentano l’idrofilicità del farmaco.
Il prodotto di queste reazioni può essere direttamente escreto oppure può essere direttamente coniugato, oppure passa attraverso un metabolita che è più attivo farmacologicamente o meno attivo. Questi metaboliti possono essere sottoposti a coniugazione, lo scopo di tutta questa biotrasformazione è quello di eliminare dall’organismo tutte le sostanze esogene che devono essere eliminate .
Enzimi che partecipano alla biotrasformazione
A queste reazioni partecipa una gran quantità di enzimi diversi, alcuni svolgono un ruolo principale, altri un ruolo secondario; in alcuni casi gli enzimi catalizzano reazioni di FASE I e di fase II.
L’enzima CYP3A4 svolge un ruolo molto grande insieme a CYP3A5 e CYP3A6; CYP2D6 e CYP2C9 insieme agli enzimi precedenti coprono quasi i ¾ delle reazioni di fase I.
Per le reazioni di fase II c’è un ruolo principale della glucuronazione, della coniugazione con l’acido gluronico per l’espulsione attraverso le urine; ma ci sono anche altri enzimi come il TPMP, famiglia delle GST (Glutatione S Transferasi) che sono enzimi di coniugazione, NAT1 e NAT 2 che sono enzimi di N-acetilazione.
