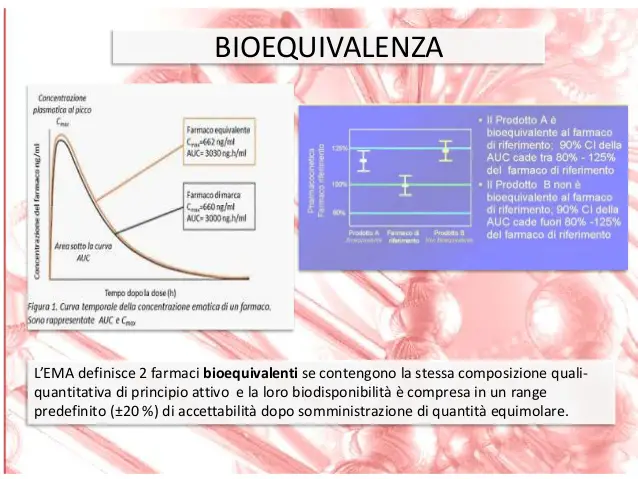
Gli equivalenti farmaceutici sono medicinali che contengono la stessa quantità dello stesso principio attivo e la stessa forma farmaceutica, ma non necessariamente gli stessi eccipienti.I due medicinali considerati possono essere definiti bioequivalenti se analizzando i profili farmacocinetici, ossia le curve concentrazione plasmatica-tempo, non si riscontrano differenze statisticamente significative.
Quando un farmaco è bioequivalente
Due medicinali sono bioequivalenti se sono equivalenti farmaceutici o se i loro profili farmacocinetici ottenuti dalla stessa dose molare sono così simili che è improbabile che si possano produrre differenze clinicamente rilevanti sugli effetti terapeutici e collaterali.
Per accertare la bioequivalenza tra due formulazioni deve essere dimostrato che sia l’entità che la velocità di assorbimento differiscono per non più di una prefissata percentuale (conferma dell’ipotesi zero, che la differenza tra le medie sia dovuta al caso). Si effettua il testi detto T di Student, distribuzione di probabilità, strumento utilizzato per esprimere intervalli di fiducia e confrontare i risultati di diversi esperimenti.
T = differenza tra le medie degli esperimenti / deviazione standard media * n° esperimenti.
Il T calcolato viene confrontato con quello tabulato, in relazione ai gradi di libertà (numero di dati disponibili per effettuare la valutazione statistica). Se il T calcolato è maggiore di quello tabulato significa che la differenza è statisticamente significativa, i dati risultano quindi diversi; se il T calcolato è inferiore a quello tabulato la differenza non è statisticamente significativa e l’ipotesi zero è confermata.
I risultati di questo test statistico non hanno un valore di assoluta certezza ma indicano una probabilità, ossia il livello di significatività del test, indicata con P; è una stima quantitativa delle probabilità che le differenze osservate siano dovute al caso. Un valore di P tendente a zero è indice di bassa probabilità, quindi indice che la differenza sia dovuta al caso.La probabilità che il valore in esame sia incluso in un intervallo stimato si chiama livello di fiducia, espresso come intervallo tra 0 e 1 o anche in percentuale. La significatività e la fiducia sono complementari, ciò significa che se la significatività è il 10% la fiducia è il 90%.
Analisi della bioequivalenza
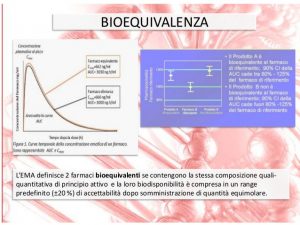
Per l’analisi della bioequivalenza si usa l’intervallo di confidenza, intervallo di valori che include il valore vero, con un certo grado di probabilità. Definisce il margine di errore possibile tra le misure. Si calcola l’intervallo di confidenza al 90% del rapporto tra i valori medi dei parametri del campione e del riferimento (AUC e Cmax). L’intervallo dei rapporti così calcolati deve essere compreso nel range 0,80-1,25 nel caso di forme logaritmiche, o 0,80-1,20 nel caso di valori non in forma logaritmica. In caso in cui l’indice terapeutico sia ristretto il rapporto deve rientrare in un range più limitato.
Studi di bioequivalenza
Per gli studi di bioequivalenza si arruola un certo numero di volontari sani, i soggetti vengono divisi in due gruppi casuali e vengono fatti due periodi di esperimento in cui: nel primo periodo si somministrano il farmaco da testare al gruppo 1 e il riferimento al gruppo 2, dopo un periodo chiamato wash-out, in cui il farmaco viene espulso dall’organismo, si invertono le somministrazioni. Si valutano le concentrazioni plasmatiche raggiunte in seguito alla somministrazione dei farmaci e si estrapoleranno i dati basati sui profili farmacocinetici ottenuti.Quindi due formulazioni sono bioequivalenti se il rapporto tra le AUC e quello tra le Cmax sono compresi tra 0,8 e 1,25 e la differenza tra le biodisponibilità è nell’intervallo del +20%.
Spesso si utilizza un generico rispetto ad un altro, in realtà non si ha un test statistico di differenza tra i due generici, ma entrambi sono stati testati rispetto al farmaco “di marca”, per cui la bioequivalenza è rispetto a quello e non è detto che i due generici siano bioequivalenti tra loro.
Differenze tecnologiche nella bioequivalenza
Se dimostrata la bioequivalenza farmacocinetica sono accettate differenze di composizione relative agli eccipienti. La variazione degli eccipienti può portare anche a una variazione della risposta, non solo in termini di effetto terapeutico (farmacocinetico) ma si possono riscontrare problemi di allergia o intolleranza; si hanno anche problemi per i farmaci con uno stretto margine terapeutico in quanto la variazione degli eccipienti può portare alla variazione della biodisponibilità determinando variazioni di efficacia e tollerabilità.
Le problematiche possono derivare dalle caratteristiche delle materie prime utilizzate, dalla tipologia di formulazione e anche dal metodo di preparazione. Per esempio una compressa per avere la sua efficacia si deve prima disgregare per essere assorbita; i fattori che influenzano la sua azione, a parità di caratteristiche chimico-fisiche, sono il tipo di disaggregante scelto, la sua concentrazione, il mantenimento dell’efficienza del disgregante, la porosità e la coesione della compressa e le caratteristiche di bagnabilità della formulazione.Nella FU si ha una scala di solubilità molto ampia, per esempio i molto solubili necessitano di 2-10 ml per sciogliere 1g di sostanza; l’eccipiente può rientrare nella stessa categoria ma essere molto diverso, nella tabella non sono riportato il tempo e la temperatura, importanti in quanto influenzano la disgregazione nel tratto GI. Anche l’uso di un sale invece che un altro influenza la solubilità.
- Tavor – lattosio, cellulosa microcristallina (glidante), polacrilin potassio (sale di potassio di una resina a scambio cationico, disgregante), magnesio stearato (lubrificante), ipromellosa (legante e idrofilizzante), macrogol 6000 (idrofilizzante), titanio diossido, talco.
- Lorazepam – lattosio monoidrato, amido pregelatinizzato (compattante e disgregante), povidone, magnesio stearato, E 110 (solo per compresse 1 mg).
- Aulin– docusato sodico (tensioattivo anionic), idrossipropilcellulosa, lattosio monoidrato, carbossimetilamido sodico A, cellulosa microcristallina, olio vegetale idrogenato, magnesio stearato.
- Nimesulide – cellulosa microcristallina, amido di mais, lattosio, sodio laurilsolfato (tensioattivo anionico), magnesio stearato, compritol 888 ATO (miscela di glicerilbenato, lubrificante).
Spesso nel prodotto originale è riportata la composizione quantitativa, cosa che non si ha nel generico anche se fondamentale in quanto una diversa quantità può comportare piccole variazioni nella velocità di assorbimento e, nonostante rimanga nell’intervallo stabilito, può portare a un diverso effetto terapeutico.