Che cos’è la sindrome di Cushing
È caratterizzata da una secrezione cronica di ACTH, che risulta in un’iperplasia della zona fascicolata e della zona reticolare del surrene e quindi, secrezione aumentata di cortisolo, di androgeni e i DOC.
E’ più comune nella donna che nell’uomo (8:1).
La causa più frequente è quella farmacologica, come conseguenza della terapia cronica con glucocorticoidi.
ACTH = Adreno Cortico Tropic Hormon; che sarebbe l’ormone adrenocorticotropo conosciuto anche come corticotropina.
Classificazione di Cushing
ACTH-dipendente
- adenoma ipofisario (Malattia di Cushing)
- neoplasia non ipofisaria (Sindrome da ACTH ectopico)
ACTH-indipendente
L’eccesso di cortisolo sopprime la secrezione di ACTH.
- neoplasia surrenalica (adenoma, carcinoma)
- iperplasia nodulare del surrene
Anatomia patologica
Malattia di Cushing
Microadenomi benigni con un diametro inferiore ai 10mm, non capsulati, ma circondati da un orletto di cellule pituitariche normali compresse. Le neoplasie di natura maligna sono rare.
Da un punto di vista istologico, i tumori sono composti da foglietti compatti di cellule uniformi, con granulazioni piuttosto grandi, con disposizione sinusoidale ed un elevato contenuto di ACTH e di peptidi ad esso correlati (β-LPH, β-endorfine).
Alterazioni di Crooke
Zona di ialinizzazione perinucleare (esposizione cronica delle cellule corticotrope all’ipercortisolismo)
Ammassi di microfilamenti perinucleari circondanti il nucleo
Iperplasia diffusa: rara. Risultato dell’eccessiva stimolazione dell’ipofisi da parte dell’ormone stimolante la corticotropina (CRH).
Iperplasia adrenocorticale
Iperplasia bilaterale della corteccia surrenale (ipersecrezione cronica di ACTH).
Iperplasia adrenocorticale semplice (malattia di Cushing)
Le ghiandole surrenali sono ingrandite, con un peso da 12 a 24g. Iperplasia delle cellule compatte della zona reticolare e delle cellule chiare della zona fascicolata, la zona glomerulare è normale.
Iperplasia nodulare
Una eccessiva produzione di ACTH sia ipofisaria che non, può portare ad un ingrandimento nodulare delle surrenali. I noduli con il passare del tempo possono diventare autonomi o semiautonomi.
Malattia nodulare adrenocorticale pigmentata (PPNAD) surrenale-dipendente: produzione di Ab stimolanti la corteccia surrenale, che si legano al recettore dell’ACTH, provocando la sintesi degli ormoni surrenalici.
Malattia familiare a trasmissione autosomica dominante.
Iperplasia massiva macronodulare del surrene ACTH indipendente e surreno-indipendente: causa sconosciuta. Grossi noduli bilaterali (3-6 cm). Presenza di recettori anormali per il peptide inibitorio gastrointestinale (GIP). L’assunzione di cibo stimola il GIP, che si lega ai recettori nella corteccia surrenale, stimolando la crescita del surrene e la biosintesi steroidea.
Sindrome da ACTH ectopico
Maggiore frequenza nei maschi (40-60 anni). Tumori non ipofisari sintetizzano ed ipersecernono ACTH biologicamente attivo. Es: Carcinoma polmonare a cellule piccole.
Surrenali ingrandite (24-50g), con iperplasia della zona reticolare (estensione cellule zona fascicolata e glomerulare) Cellule della zona fascicolata ridotte (elevati livelli di ACTH).
Le secrezioni di ACTH e cortisolo sono episodiche in modo casuale, con livelli elevati (assenza feedback negativo).
Tumori surrenalici
Indipendenti dall’ACTH (adenomi e carcinomi) secrezione autonoma degli steroidi corticosurrenalici (livelli circolanti ACTH soppressi) assenza di controllo ipotalamo ipofisario (non responsivi a trattamento farmacologico)
- Adenomi surrenalici secernenti glucocorticoidi: adenomi capsulati (10-70g) dal diametro di 1 fino a 6 cm (prevalenza di cellule della zona fascicolata). Il quadro clinico è tipico dell’eccesso di glucocorticoidi e non sono presenti effetti androgenici.
- Carcinomi surrenalici: peso superiore ai 100g. Sono capsulati e vascolarizzati (zone di necrosi, emorragia e degenerazione cistica). Eccesso di cortisolo ed androgeni (ormoni adrenocorticali). Presenza di ipokaliemia ed ipertensione (effetti mineralcorticoidi del cortisolo); dolore addominale, masse addominali palpabili e metastasi polmonari ed epatiche.
Patogenesi
- ipersecrezione di ACTH con iperplasia corticosurrenalica bilaterale ed ipercortisolismo;
- assenza del ritmo circadiano della secrezione di ACTH e cortisolo (secrezione ACTH casuale ed episodica);
- mancata risposta dell’ACTH e del cortisolo allo stress (ipoglicemia o chirurgia) → soppressione funzione ipotalamica e secrezione di CRH da parte dell’ipercortisolismo;
- anormale feedback negativo sulla secrezione di ACTH ad opera dei glucocorticoidi;
- risposta inferiore al normale di GH, TSH e gonadotropine ai test di stimolazione;
- eccesso di androgeni parallelo a quello dell’ACTH e del cortisolo.
Donna → irsutismo, acne ed amenorrea
Uomo → inibizione LH da parte del cortisolo → ↓ testosterone → ↓ libido ed impotenza
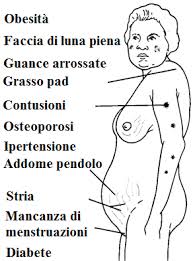
Segni clinici – Malattia di Cushing
- obesità (accumulo grasso faccia (luna piena), dorso (zona sopraclavicolare e dorsocervicale (gobba di bufalo), tronco e addome;
- manifestazioni cutanee:
- atrofia epidermide e connettivo sottostante;
- facilità alle ferite;
- strie rosse o purpuree (prevalentemente addominali);
- acne
- infezioni fungine (unghie e candidiasi orale)
- rara iperpigmentazione della pelle
- irsutismo: 80% femmine. ↑ crescita dei peli → faccia, addome, seni, torace e cosce;
- ipertensione
- disfunzioni gonadiche: amenorrea ed infertilità (donne); riduzione libido, peli corporei e volume dei testicolo (uomo);
- disturbi psicologici: labilità emotiva, irritabilità, ansia, depressione, perdita di memoria, disturbi del sonno, psicosi o allucinazioni (suicidio);
- muscoloscheletriche: osteopenia (fratture inesplicabili piedi, costole e vertebre, dolore alla schiena) e stanchezza muscolare (in particolare, arti inferiori);
- metaboliche:
- intolleranza al glucosio
- diabete (20%)
- iperlipidemia
- poliuria (inibizione da parte dei glucocorticoidi della vasopressina, ormone antidiuretico ed aumento della clearance metabolica dell’H2O da parte del cortisolo)
- calcolosi renale
Diagnosi – Malattia di Cushing
Indagini biochimiche (valutazione generale del paziente in relazione alla presenza di altre patologie):
- Test di soppressione con Desametasone
- Cortisolo libero urinario
- Ritmo diurno
Diagnosi differenziale – Malattia di Cushing
- ACTH Plasmatico
- RMN ipofisaria
- Soppressione a dosi elevate di desametasone
- Sampling dei seni petrosi inferiori
- ACTH ectopico occulto
- Procedure di localizzazione surrenalica
Terapia: rimozione della lesione alla base e correzione dell’iperincrezione di ormoni surrenalici, senza indurre danno all’ipofisi o al surrene.
Terapia – Malattia di Cushing
- microchirurgia
- varie forme di terapia radiante
- inibizione farmacologica della secrezione di ACTH: ketoconazolo, aminoglutetimide e mitomane
- Sindrome da ACTH ectopico: terapia possibile solo se i tumori sono benigni.
Tumori surrenalici
- Adenomi surrenalici: surrenalectomia unilaterale (laparoscopia); terapia con glucocorticoidi (durante e dopo l’intervento fino a quando il surrene controlaterale non riprende la sua funzione)
- Carcinomi surrenalici: terapia poco efficiente a causa di metastasi (fegato, polmoni)
Trattamento operatorio: raro (riduzione massa tumorale ed ipersecrezione steroidea)
Trattamento medico: mitomane (70% secrezione di steroidi, 35% riduzione volume tumore)
Prognosi
- Sindrome di Cushing: se non trattata può portare a morte (tumore stesso o eccessivo ipercortisolismo
- Malattia di Cushing: buon trattamento, grazie al miglioramento delle tecniche microchirurgiche e della terapia radiant
- Tumori surrenalici: ottima negli adenomi; non buona nei carcinom
- Sindrome da ACTH ectopico: prognosi sfavorevole (tumori maligni o ipercorticismo severo); prognosi migliore (tumori benigni).

