I peptidi come recettori per gli oppioidi
Esistono altre tipologie di neurotrasmettitori come i peptidi possono avere questa funzione.
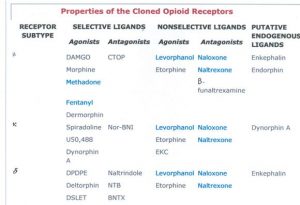
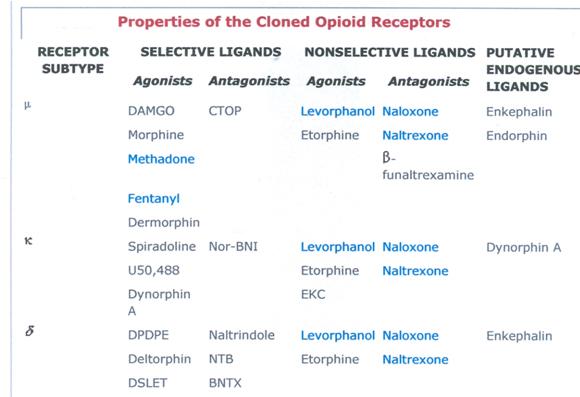
I primi peptidi coperti sono endo-oppioidi.
L’oppio è una droga non-organizzata, un latice condensato che si estrae dal Papaverum somniferum e viene usato come analgesico per importanti traumi. Contiene morfina, un alcaloide fenantrenico, in quantità rilevanti.
La morfina e i peptoidi
La morfina agisce come agonista su tre tipi di recettori: μ (1-3); κ (1-2) e δ (1-2), tutti metabotropici accoppiati a proteinaGi (inibiscono l’adenilato-ciclasi), eterocettori presinaptici inibitori.
Questi agonisti corrispondono a tre classi endogene: endorfine (più affini per mu); encefaline (più affini per delta) e dinorfine (più affini per kappa).
Morfina e peptidi endogeni hanno una vasta serie di effetti e vengono usati principalmente come antidolorifici.
L’azione analgesica dei recettori per gli oppioidi
La loro azione analgesica ha due meccanismi principali:
- spinale
- sovraspinale;
entrambi legati all’organizzazione dell’impulso nervoso raccolto dai neuroni nocicettivi.
Via spinale
Il neurone nocicettivo primario percepisce lo stimolo doloroso e lo trasforma in un potenziale d’azione; prende contatto sinaptico (nelle corna dorsali del midollo spinale) con l’interneurone spinale (nocicettivo secondario), che arriva ai centri superiori (talamo); da qui si ha lo smistamento del segnale con il trasferimento alla corteccia somatosensoriale e al limbo.
Gli oppioidi agiscono a livello delle corna dorsali; qui si hanno recettori μ e δ (principalmente) in posizione presinaptica tra il neurone primario e il secondario e sul corpo de neurone secondario.
l’attivazione di questi recettori comporta l’inibizione del rilascio di una buona parte di sostanza P; se passa qualcosa si ha l’azione sul neurone secondario che non permette il passaggio dell’impulso.
Via sovraspinale
Come in tutti i circuiti neurologici si ha un’autolimitazione: neuroni efferenti che originano nella zona grigia periacqueduttale, noradrenergici o serotoninergici.
Il meccanismo sovraspinale degli oppioidi porta a un incremento del rilascio dei mediatori di questi neuroni. I recettori inibiscono i sistemi inibitori; questo meccanismo depone per l’attività della dipendenza da morfina. Lo schema si può proiettare sull’area tegumentale ventrale e sul nucleus accumbens. Un aumento di dopamina a questo livello porta a un aumento del piacere e del bisogno di riprovarlo. Ciò è dovuto al fatto che i neuroni di quest’area sono inibiti da neuroni GABAergici che presentano molti recettori in posizione presinaptica, tra cui i μ.
I recettori per gli oppioidi sono distribuiti anche sui neuroni colinergici intestinali, l’attività di questi recettori promuove l’inibizione del release dell’acetilcolina, che aumenta motilità e secrezioni intestinali (gli oppioidi provocano stipsi).
Morfina. Data una dose di morfina per os solo 1/3 va in circolo e solo 1/3 di questa attraversa la barriera ematoencefalica; per questo motivo la somministrazione parenterale è la migliore.
ai fini terapeutici si usa come analgesico sulle corna dorsali del midollo spinale (SNC, non coperto dalla barriera ematoencefalica).
L’uso di morfina per fini voluttuari è più difficile, si ha una azione lenta e graduale a livello sovraspinale. I gruppi che ostacolano l’attraversamento della barriera sono gli ossidrili in 3 e 6; la manipolazione chimica degli ossidrili ha portato all’ottenimento del derivato di-acetilico: l’eroina.
L’eroina
Questo farmaco passa la barriera ematoencefalica; l’iniezione parenterale porta a un picco immediato delle concentrazioni nel nucleus accumbens, pari a quelle plasmatiche.
L’eroina non è attiva di per se ma viene velocemente convertita nel derivato monoacetilato 6MAM, primo metabolita attivo; subisce un ulteriore metabolismo, più lento, la rimozione idrolitica a carico dell’acetile in 6 che porta alla morfina, secondo metabolita attivo.
La rimozione delle due funzioni esteree richiede enzimi diversi: quello in 3 viene rimosso da esterasi plasmatiche e carbossiesterasi epatiche; quello in 6 non viene rimosso dalle esterasi plasmatiche, ma solo da quelle epatiche.
La morfina subisce altre vie metaboliche:
- N-demetilazione; dal sistema microsomiale epatico (normorfina, attiva).
- Coniugazione con acido glucuronico in 3 o 6; i derivato è eliminato tramite le vie biliari, qui viene rimosso il glucuronide da parte di batteri intestinali e la morfina libera viene riassorbita. Il 6-glucuronide ha ancora una certa attività.
Un eccesso di morfina in circolo porta a una depressione bulbare; la collocazione dei recettori μ a questo livello prepone per una tossicità acuta. Una particolarità della tossicità è la forzazione miotica, costrizione della pupilla (e bradipnea); per intervenire si usa naloxone, antagonista recettoriale degli oppioidi.
Se il SNC è abituato alla presenza degli oppioidi va incontro all’adattamento e si hanno effetti di tolleranza. L’organismo si adatta alla presenza del farmaco attraverso meccanismi compensatori, in questo caso non si ha tolleranza farmacocinetica, ma farmacodinamica. La tolleranza farmacodinamica è crociata, non solo per la morfina ma per tutti i farmaci con quel meccanismo; è anche legata alla down-regulation recettoriale, i recettori presenti trasducono peggio il segnale, aumenta l’attività dell’adenilato-ciclasi basale e diminuisce il livello basale dei mediatori endogeni degli oppioidi.
La mancata somministrazione porta a un quadro sintomatologico opposto a quello della morfina; raramente si ha una sintomatologia letale. L’alcool invece da una sindrome ugualmente brutale ma può portare alla morte.
Trattamenti per la sindrome da astinenza da eroina
Ci sono vari trattamenti per la sindrome da astinenza da eroina:
- Occupazione del recettore, disabituando il soggetto al regime di auto-somministrazione; uno dei farmaci più usati in questa terapia è il metadone, agonista dei recettori della morfina con buona potenza. Assorbito e somministrato per os, compare più lentamente rispetto a una endovenosa di eroina (non si ha il picco di benessere) però attiva i recettori e il soggetto non va in astinenza. Il problema del metadone è dato dal fatto che il paziente non si affeziona alla terapia, proprio per la mancanza del picco di benessere.
- Strategie con dosi a scalare di eroina, ancora illegali.
- Buprenorfina, agonista μ e δ, antagonista κ. Molecola con un profilo interessante perché mima molte delle azioni della morfina limitando la sindrome di astinenza. Il κ è coinvolto nella sfera psicotropa della morfina; un farmaco come questo porta ad avere lucidità, senza dolori. I primi pazienti trattati con buprenorfina (orale) scioglievano il farmaco e lo assumevano per via endovenosa, si è ovviato il problema mischiando la buprenorfina con naloxone; infatti per via orale il naloxone non viene assorbito.