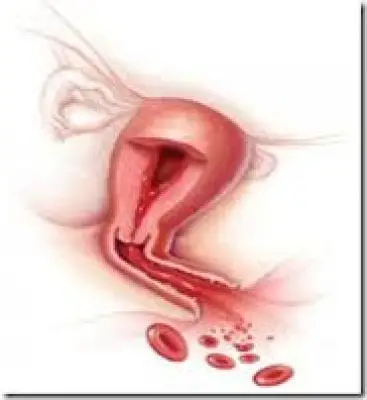
Sanguinamenti Uterini Anomali – molto frequenti in tutte le donne in pre-menopausa
I sanguinamenti uterini anomali , il cui nome viene abbreviato in AUB, sono la prima causa di ospedalizzazione nel mondo per il sesso femminile in età riproduttiva e rappresentano un’entità clinica estremamente comune.
Si stima che più del 20% delle donne in età superiore a 35 anni, prima della menopausa, sia affetta da sanguinamento mestruale eccessivo (HMB).
Inoltre si è stimato che l’impatto economico sia molto rilevante.
Studi e ricerche sui sanguinamenti uterini anomali
In realtà, sebbene sia una problematica antica quanto è antico il genere umano, fino a poco tempo fa, tantissima confusione esisteva sulla classificazione di questo genere di problematiche. Questo perché, ognuno nel mondo, utilizzava un nome diverso per definire la stessa entità clinica. Di conseguenza, si ha da un lato l’incapacità a condurre degli studi sistematici omogenei e difficoltà a tirare fuori dei dati in maniera sistematica da tutti gli studi che erano stati svolti precedentemente sull’argomento (ovviamente se si vuole condurre una review sistematica utilizzando delle parole chiave discordanti tra tutti gli studi valutati, questo è un fattore fortemente limitante la qualità degli studi). Dall’altro lato, la mancanza di un sistema di classificazione univoco, impediva la corretta gestione delle pazienti, che magari si spostavano da un centro all’altro gestite da più colleghi che, utilizzando termini diversi, causavano confusione nella gestione della paziente.
Quindi Sia la ricerca, che la pratica clinica, sono state fortemente compromesse nel management delle pazienti con AUB a causa di:
- Elenco confuso di termini descrittivi
- Assenza di un sistema di classificazione delle cause di AUB
- Assenza di una definizione condivisa di AUB clinicamente significativo
È stato pure pubblicato uno studio in cui è stata fatta un’intervista a vari ginecologi, chiedendogli se secondo loro la menorragia (termine che prima veniva utilizzato per indicare un sanguinamento uterino anomalo per quantità, quindi eccessivo per volume di sangue perso), veniva considerato come :
- Descrittivo di un segno o di un sintomo
- Diagnosi
- Entrambi
Dalle risposte molto varie e soggettive, si sottolineò la confusione circa l’argomento.
Questa è la ragione per cui, pochi anni fa, tutte le società di ginecologia ed ostetricia del mondo si sono riunite per cercare di fare una nuova classificazione, che viene chiamata classificazione FIGO, dei sanguinamenti uterini anomali.
Questo ha rivoluzionato molto il nostro modo di gestire la problematica.
Nuova nomenclatura per gli AUB
Venne così istituito il concetto di AUB inteso come Abnormal Uterin Bleeding, ovverocome concetto generale di alterazione della Quantità, Qualità, Durata, Frequenza del flusso mestruale, con dei cut-off che sono stati definiti in base ai percentili della popolazione generale, riferendosi quindi alla curva di normalità della popolazione.
Si utilizzano adesso dei termini estremamente chiari, sia per la comunicazione con la paziente, sia per la comunicazione tra gli specialisti.
Classificazione dei sanguinamenti uterini AUB
Quindi adesso gli AUB si classificano per:
1. Frequenza
- Frequente < 24 giorni (prima definita come polimenorrea).
- Normale à frequenza compresa tra 24 e 38 giorni; quindi il classico concetto per cui se non si aveva il ciclo ogni 28 giorni veniva considerato irregolare, viene abbandonato.
- Infrequente > 38 giorni (prima definita come oligomenorrea).
2. Regolarità de ciclo
- Assente
- Regolare variazione tra un mese e l’altro tra i 2 e i 20 giorni
- Irregolare > 20 giorni
3. Durata
- Prolungato > 8.0
- Normale 4.5 – 8.0
- Ridotto < 4.5
4. Volume
Questo è un concetto un po’ più difficile da definire per la paziente, però si può chiedere di quantificare i tamponi riempiti durante la giornata e poi attraverso delle apposite schede in cui vi sono delle tabelle di conversione, si ottiene il valore in ml.
- Abbondante > 80 ml
- Normale 5-80 ml
- Scarso < 5 ml
Continuando a parlare della terminologia, viene abbandonato completamente il vecchio termine “dysfunctional uterine bleeding” , che è stato sostituto da un set di 3 categorie di patologie che spiegano l’insorgenza di AUB in donne in assenza di cause uterine organiche e strutturali (coagulopatie, disordini dell’ovulazione, e disordini endometriali)
Distinguiamo:
- AUB ACUTOàepisodio di sanguinamento vaginale di entità sufficiente da richiedere interventi immediati per prevenire ulteriore perdita ematica.
- AUB CRONICO àsanguinamento uterino anomalo per durata, volume e\o frequenza presente negli ultimi 6 mesi.
Amenorrea
Un termine che invece non è cambiato rispetto a prima, è Amenorrea intesa come assenza di flusso mestruale per almeno 6 mesi consecutivi.
Il termine HMB (Heavy Mestrual Bleeding) descrive un flusso mestruale che secondo la prospettiva della donna è anomalo per volume, a prescindere dalla regolarità, frequenza e durata; quindi la paziente riferisce di un ciclo che comunque interferisce con la sua qualità di vita.
Sanguinamento intermestruale il famoso “spotting”, ovvero un episodio di sanguinamento che si presenta al di fuori dei normali flussi mestruali.
La classificazione FIGO : cause di AUB in epoca riproduttiva
La nuova classificazione FIGO distingue due diverse categorie, con un acronimo abbastanza facile da ricordare PALM-COEIN. In particolare l’acronimo PALM si riferisce alle cause strutturali ed organiche di sanguinamento uterino anomalo, mentre COEIN alle cause non organiche, non strutturali che non possono essere visualizzate.
In realtà, del gruppo PALM fanno parte entità che possono essere viste ma non essere la vera causa del sanguinamento, mentre quelle del gruppo COEIN, presenti in pazienti con uteri strutturalmente normali, possono essere la causa ma non essere viste.
Del primo gruppo fanno parte:
- Polipi
- Adenomiosi
- Leiomiomi o Fibromi
- Patologie Intracavitarie maligne o borderline (cancro dell’endometrio e l’iperplasia)
Del secondo gruppo, invece, fanno parte:
- Coagulopatie (alterazioni della cascata coagulativa)
- Disfunzioni ovulatorie (alterazioni ovulatorie)
- Alterazioni endometriali, ma che non siano alterazioni organiche
- Alterazioni iatrogene
- Non ancora classificate
Valutazione minima richiesta
La FIGO definisce anche quello che dovrebbe essere il work up diagnostico minimo che un qualsiasi operatore, in qualsiasi parte del mondo, dovrebbe garantire ad una paziente che si reca a controllo dichiarando di avere un sanguinamento uterino anomalo:
- Anamnesi à per la definizione della frequenza, ciclicità e volume del sanguinamento
- Ecografia transvaginale (ETV) àper diagnosticare patologie organiche uterine (gold standard)
- Isteroscopia o isterosonografia àper diagnosticare patologie organiche intracavitarie
- Emocromo, coagulazione ed ematocrito per diagnosticare disturbi ematologici
Cause strutturali organiche di AUB:
Polipi Endometriali (Aub-P) detti anche polipi uterini
I polipi endometriali sono disordini ginecologici comuni la cui incidenza è sconosciuta (spesso asintomatici) e la cui prevalenza è riportata essere tra il 7.8% e il 34.9%, a seconda della popolazione in studio.
Questi polipi, sono i “fratelli gemelli” delle cisti da follicoli persistenti di cui abbiamo parlato la scorsa volta, perché allo stesso modo, sono patologie che durante l’epoca riproduttiva sono molto frequenti ma che hanno un significato patologico praticamente pari a zero. Questo perché i polipi, non sono altro che proliferazioni di tessuto endometriale che prolifera in maniera eccessiva e che talvolta si organizza a formare questa struttura esofitica, polipoide, che origina dalla mucosa endometriale e che aggetta all’interno della cavità uterina.
Vengono scolasticamente distinti in :
- Peduncolati (più frequenti)
- Sessili in relazione alla base di impianto sull’endometrio (stretta e allungata nel primo caso, larga e appiattita nel secondo);
possono essere sia singoli che multipli e vanno da pochi millimetri a diversi centimetri, con possibilità di sporgere in vagina per dimensioni superiori a 2cm.
Altre volte invece, si manifesta come quella che chiamiamo Iperplasia polipoide, in cui in realtà, è tutto l’endometrio ad essere inspessito. In quest’ultimo caso, quando facciamo l’isteroscopia, vediamo la mucosa che invece di essere sottile come dovrebbe essere in fase luteale, è molto mammellonata, molto disomogenea, ma comunque con caratteristiche di benignità.
Patogenesi sono il risultato di un’intensa ed esuberante proliferazione cellulare endometriale stimolata dagli estrogeni e non controbilanciata adeguatamente dal progesterone.
Per questo motivo, i polipi endometriali si riscontrano frequentemente in età pre-climaterica, periodo caratterizzato da livelli estrogenici fluttuanti.
NB: ricordiamo sempre che l’estrogeno fa proliferare la mucosa, mentre il progesterone la differenzia.
Fattori di rischio per i polipi uterini
Fattori di rischio indipendenti per lo sviluppo di poliposi endometriali:
- L’obesità,
- l’ipertensione arteriosa,
- pregressi polipi cervicali (ci deve fare sempre sospettare la possibilità di un concomitante polipo endometriale),
- la terapia ormonale sostitutiva
- e la terapia con tamoxifene.
Alla ETV (ecografia transvaginale), un polipo endometriale appare tipicamente come una lesione iperecogena, con margini regolari, all’interno del lume uterino; inoltre se usiamo il doppler, vediamo un asse singolo vascolare, il che ci permette di differenziarlo dai fibromi sottomucosi perché quest’ultimi hanno una circolazione diffusa, circonferenziale.
Molto spesso questi polipi sono asintomatici e quindi sono dei riscontri occasionali durante controlli ecografici di routine.
Tuttavia, quando sintomatici, di solito si manifestano con una sintomatologia caratterizzata da sanguinamenti anomali per regolarità, ovvero sanguinamenti intermestruali casuali. Quando questo polipo sporge verso il canale, si possono avere dei sanguinamenti durante il rapporto sessuale. Oppure, quando le dimensioni di questo polipo sono particolarmente importanti, si può avere anche un aumento della quantità del ciclo.
Nel report del 2012 dell’AAGL (Società Americana Ginecologi Laparoscopisti) sopra riportato, si sottolinea che fino ad un 25% dei pazienti in epoca riproduttiva, guarirà da solo dalla presenza di questi polipi. Quindi, in queste pazienti, un management di attesa può essere assolutamente raccomandato.
Polipi uterini, bassissimo il rischio di cancro
È stata fatta una stima secondo cui, prima della menopausa, il rischio di cancerizzazione, ovvero il rischio che un polipo endometriale in una donna in epoca riproduttiva si trasformi, o già trasporti in se cellule di tipo neoplastico, è addirittura dello 0,03%.
Quindi devono essere fatte più di 3000 polipectomie isteroscopiche per andare a diagnosticare 1 carcinoma endometriale.
Ovviamente, guardando questi dati, capiamo che non vi è un adeguato rapporto costo-beneficio sia da un punto di vista economico, sia dal punto di vista della paziente. Infatti, nel caso in cui la paziente abbia fattori di rischio per la formazione di polipi, è probabilmente destinata nella sua vita ad avere più episodi di polipi e molto spesso queste sono quelle pazienti che dopo numerose isteroscopie preferirebbero farsi rimuovere l’utero piuttosto che sottoporsi ad ulteriori trattamenti.
Quindi, le pazienti in epoca riproduttiva vanno sempre tranquillizzate sul fatto che si tratta comunque di patologie benigne. Bisogna inoltre, come nel caso delle cisti funzionali, attendere almeno 3 cicli mestruali prima di decidere eventualmente di procedere con l’isteroscopia.
Somministrazione di farmaci per indurre la scomparsa dei polipi uterini
In questi tre cicli di attesa, possiamo cercare di ristabilire quel rapporto errato estrogeni\progesterone, somministrando un progestinico nella fase luteale del ciclo. Se quindi vogliamo aiutare la paziente, lo possiamo fare cercando di accelerare il processo di scomparsa di questo polipo somministrano progesterone per via vaginale o nella nuova formulazione idrosolubile (somministrabile anche per via sottocutanea). La somministrazione va fatta nella seconda metà del ciclo, quindi dal 14esimo giorno del ciclo, per 14 giorni.
Di solito un ciclo di tre mesi di questa terapia, non solo fa stare meglio la paziente perché riduce la sintomatologia nel caso di AUB, ma soprattutto perché spesso è terapeutico e quindi già sufficiente per eliminare la causa organica del polipo.
Qualora vedessimo dopo 3 cicli che il polipo non è scomparso, allora si va a fare l’isteroscopia, che molto spesso è sia diagnostica che terapeutica, in quanto durante l’esame stesso, senza bisogno di anestesia e con delle “forbicette” riusciamo ad asportare completamente il polipo.
Qualora invece, questo polipo sia di dimensioni talmente grandi da non essere più sufficiente la pinzetta isteroscopica, in questo caso la paziente verrà preparata con un analogo del GnRH per cercare di ridurre il più possibile la proliferazione estrogenica e poi si farà sempre un intervento per via vaginale ma in cui invece di utilizzare l’isteroscopio di Bettocchi, quello piccolino da 3 mm, utilizzerò il Resettoscopio. Quest’ultimo è uno strumento un po’ più grande di calibro e quindi richiede l’utilizzo della dilazione del collo dell’utero con un’anestesia come quella utilizzata nel caso di un raschiamento. La procedura vedrà l’utilizzo di una corrente monopolare per resecare la base di questo polipo ed asportarlo. Si tratta comunque sempre di un intervento non invasivo.
Adenomiosi (Aub-A)
Condizione patologica in cui le isole di tessuto endometriale ectopico si trovano nel contesto del miometrio, talora organizzate a formare un vero e proprio nodulo, detto adenomioma.
Patologia frequente nelle donne di età compresa tra i 40 e di 50 anni.
I meccanismi etiopatogenetici sono ignoti ma appaiono diversi da quelli che sostengono l’endometriosi esterna.
Fattori di rischio: dell’ adenomiosi
- pluriparità,
- interventi diagnostici o terapeutici endouterini in anamnesi;
Infatti, tutto quello che in qualche modo va ad alterare la normale anatomia uterina può essere causa di adenomiosi iatrogena. Alcune volte si può avere endometriosi sul sito di incisione cutanea nelle pazienti che fanno un cesareo, oppure abbiamo la possibilità di portarci dei focolai ectopici di endometrio sulla cute o sulle cicatrici laparotomiche di pazienti che fanno interventi sull’utero.
Talvolta asintomatica. Quando sintomatica invece, può causare:
- Dismenorrea e Dispareunia, secondarie ad un aumento di volume dell’utero e, che si accentua in fase premestruale.
- Aumento del sanguinamento mestruale (HMB), forse per alterata contrattilità del miometrio, per cui i meccanismi di emostasi intrauterini vengono ad essere disagevolati.
Fino a poco tempo fa, fare diagnosi di adenomiosi era una sfida. Si faceva quasi sempre una diagnosi a posteriori, anatomopatologica, e anche oggi la diagnosi di certezza è sempre fatta dall’anatomopatologo. Oggi tuttavia, abbiamo gli strumenti per poter sospettare la presenza di una adenomiosi anche semplicemente facendo una buona ecografia trans vaginale.
Ci sono stati degli studi che hanno confrontato l’accuratezza diagnostica della Risonanza Magnetica vs Ecografia e si è visto che in mani esperte, oggi, questi due esami sono comparabili, con la differenza che la RM è un esame poco utilizzabile e più costoso rispetto ad una ecografia.
Lo stesso gruppo che ha realizzato l’algoritmo IOTA che utilizziamo per la classificazione delle masse ovariche, ha fatto un altro lavoro di revisione sistematica anche per quelle che sono le patologie uterine. Questo algoritmo si chiama MUSA e vedete come in questa immagine a lato sono schematizzate in maniera semplice le caratteristiche peculiari che ecograficamente contraddistinguono la presenza di adenomiosi.
Caratteristiche ecografiche tipiche dell’adenomiosi
- Asimmetria di spessore(differente spessore tra la parete anteriore e posteriore dell’utero, misurato dalla parete anteriore fino all’endometrio e viceversa dall’endometrio fino alla parete posteriore) àciò deve fare sospettare che all’interno della parete più spessa siano presenti dei foci
- Cisti anecogene
- Isole iperecogenein maniera puntellata nel contesto di un miometrio altrimenti omogeneo
- Cono d’ombra posteriore(utero con alterazioni delle proprie caratteristiche)
- Linee ecogene subendometriali
- Vascolarizzazione translesionale àpresenza di vasi che attraversano la lesione stessa; questa è una differenza con i fibromi che hanno invece una vascolarizzazione periferica
- Irregolarità della linea giunzionale
- Interruzione della linea giunzionale
Grazie a queste caratteristiche ecografiche, la diagnosi ecografica ha un’accuratezza molto elevata, intorno al 95%. Se a questa si aggiunge l’anamnesi e altri sintomi come un’endometriosi, la diagnosi sarà facilitata.
L’adenomioma
L’adenomiosi può essere diffusa o si può presentare come un nodulo singolo, che si chiama adenomioma.
L’adenomioma si differenzia dal fibroma perché il primo, da un lato non ha una capsula sclerotica che lo circonda, i margini sono meno netti, e soprattutto ha una vascolarizzazione estremamente diversa da quella del fibroma, che è periferica e circonferenziale; infatti nell’adenomioma la vascolarizzazione è assolutamente disorganizzata e attraversa tutto lo spessore della formazione, vascolarizzazione che si definisce come vascolarizzazione centrale.
Leiomiomi (Aub-L) (anche chiamato fibroma o mioma)
I miomi sono neoformazioni mesenchimali benigne del viscere uterino. Caratterizzate dalla proliferazione di tessuto miometriale mesenchimale che si organizza a formare delle isole di miometrio nel contesto del miometrio stesso.
Sono in genere multipli (fibromatosi uterina), con minor frequenza solitari (mioma singolo). In realtà si pensa chela genesi di queste due forme sia completamente diversa ed anche le alterazioni genetiche che ne stanno alla base siano completamente diverse. Infatti, mentre il fibroma singolo è una formazione che quando rimossa chirurgicamente può anche non recidivare, una paziente con un utero come quello nella foto sopra riportata, quindi con fibromatosi uterina, non è una paziente da trattare chirurgicamente con una miomectomia multipla, in quanto vi è una probabilità di recidiva anche del 100% in tempi relativamente brevi.
È la patologia uterina in assoluto più frequente con un’incidenza intorno al 5% della popolazione generale anche se in realtà è un’incidenza sicuramente sottostimata in quanto più della metà dei fibromi non da nessun segno di se e non sarà mai sintomatico e quindi potrebbe non venire mai diagnosticato.
Rari prima dei 20 anni, per la lenta crescita si rendono in genere evidenti verso la quarta decade di vita delle donne, con incidenza che si avvicina al 20%.
Le donne di razza nera presentano una frequenza tre volte maggiore delle donne di razza bianca.
Anatomia patologica dei Leiomiomi
La dimensione varia da qualche millimetro a decine di centimetri.
Hanno una forma tondeggiante e sono costituiti da fibre di tessuto muscolare liscio con andamento concentrico a spirale con tessuto connettivo fibroso, che tende a formare una pseudo capsula periferica (visibile anche macroscopicamente durante un intervento, ed infatti viene utilizzata per scegliere il piano di clivaggio durante l’intervento stesso; tale capsula è visibile anche ecograficamente in maniera abbastanza distinta), che è ancorata al miometrio da ponti fibro-muscolari, di dimensioni ed andamento variabile.
Possono avere una localizzazione varia (97% a carico del corpo uterino e 3% a carico della cervice).
- Alcuni miomi vengono definiti “a basso grado di malignità” (STUMP) , in quanto all’esame istologico vengono evidenziate alterazioni mitotiche in numero ben limitato (meno di 10/1000 mitosi moderatamente alterate). Hanno delle caratteristiche intermedie tra il mioma benigno al 100% e la controparte maligna che è rappresentata invece dal Sarcoma uterino. Il problema degli STUMP non è mai che da soli determinano l’exitus della paziente, perché sono delle patologie borderline non maligne, ma siccome tendono a recidivare in maniera estremamente più frequente del fibroma normale, queste sono delle pazienti che muoiono o per i ripetuti interventi o per le complicanze di questi numerosi interventi. Quindi la vera problematica dello STUMP è l’alta frequenza con cui queste patologie recidivano.
- Sono eccezionali per frequenza i fibromi “parassiti”, ovvero quei fibromi che non hanno nessun rapporto di continuità con l’utero. Essi hanno perso la connessione vascolare originale, acquisendone una succedanea, in genere dall’omento. Questi sono dei fibromi che si evidenziano nel contesto della parete pelvica e che di solito sono legati alla dispersione di tessuto miometriale nel corso di una miomectomia. Questo può capitare soprattutto quando viene asportato un fibroma in laparoscopia: infatti, quando dobbiamo portare all’esterno un fibroma di 5 cm da un’incisione di 1 cm senza dover allargare l’incisione perdendo i vantaggi della laparoscopia, si utilizzano degli strumenti che in realtà oggi sono molto discussi, i morcellatori. Questi strumenti sono costituiti da una lama rotante che dal fibroma crea delle “carote” di 1 cm circa, che possono passare dalla piccola incisione cutanea. Nel corso di questo procedimento però, dei pezzettini di questo fibroma possono disperdersi nella pelvi. Successivamente, in casi particolari di peritonei particolarmente recettivi, questo frustoli di tessuto possono crearsi un proprio asse vascolare e cominciare a crescere come fibromi parassiti. Ovviamente, fino a quando a finire nella pelvi è un frammento minuscolo di fibroma uterino, ci preoccupiamo poco, ma se in realtà questo fibroma era un sarcoma misconosciuto, quindi non diagnosticato, capite bene che abbiamo disseminato una malattia mortale facendo passare la paziente da un I ad un IV stadio. Questo è il motivo per cui vi è stata un’intensa polemica negli Stati Uniti sull’utilizzo di questi morcellatori che oggi sono quasi stati banditi anche dopo il caso mediatico di un’anestesista che ha subito la disseminazione di un sarcoma. Ad oggi quindi, c’è un’accesa polemica al riguardo, in quando se da un lato è vero che vi è il rischio di disseminazione di sarcoma uterino che mette a repentaglio la vita di una paziente, dall’altro lato è altrettanto vero che il sarcoma uterino è una patologia estremamente rara ( incidenza <0,1%) e che quindi andare ad eleminare il vantaggio di un a miomectomia laparoscopica a tutte quelle pazienti che ne potrebbero beneficiare, a fronte di un rischio di patologia neoplastica così basso, in realtà ha un rapporto rischio-beneficio fortemente a sfavore di questa nuova politica “anti morcellatori”. Questo è il motivo per cui si stanno cercando delle modalità diagnostiche preoperatorie per cercare di escludere il rischio di sarcoma e quindi lasciare a disposizione di tutte le pazienti con patologia benigna la laparoscopia, e solamente a quelle a rischio eventualmente indicare un intervento laparotomico.
- Fenomeni emorragici o di insufficiente apporto ematico, possono condurre a necrosi o a fenomeni di degenerazione cistica, ialina, mixomatosa e calcificazione, più frequente in post menopausa.
Leiomiomi – sintomi
La maggioranza di pazienti con miomi, specie se di piccole e medie dimensioni, è asintomatica.
La sintomatologia varia secondo la localizzazione, il volume, il numero.
Il sintomo più frequente è il AUB (HMB) presente in circa il 30% delle pazienti.
Più raramente i miomi solo se di grandi dimensioni, causano senso di peso pelvico, gonfiore e tensione e dolenzia addomino-pelvica.
La pollachiuria compressiva è causata da miomi della parete anteriore, a livello basso o da miomi voluminosi a prevalente sviluppo anteriore.
Il dolore pelvico acuto è causato da torsione di miomi peduncolati (attaccati all’utero soltanto da un piccolo peduncolo di tessuto) o da necrosi di miomi in rapida crescita, più frequente in gravidanza.
I fibromi e il sanguinamento anomalo
Il motivo per cui i fibromi siano legati al sanguinamento uterino anomalo, ancora non è del tutto chiaro. Ci sono tante tesi che probabilmente sono tutte in qualche modo corrette:
- Il fibroma da sanguinamento per il semplice fatto che c’è un aumento della superfice endometriale
- Di certo vi è anche un alterazione della vascolarizzazione e dei meccanismi di coagulazione di questo utero fibromatoso
- Può essere anche che il sanguinamento provenga dal mioma stesso
Quello che è certo è che c’è tutta una serie di alterazioni fra fattori angiogenetici procoagulativi e anticoaguloativi che in ultima analisi determinano una alterazione dei meccanismi di emostasi.
Non tutti i fibromi sanguinano, e ovviamente quelli che sanguinano di più sono quelli che si trovano nel contesto o nelle vicinanze della cavità endometriale.
I fibromi possono essere classificati per sede, a seconda della loro proliferazione:
- All’interno del miometrio
- Nello spessore del miometrio
- All’esterno del miometrio
In ordine, i primi che vediamo sono i cosiddetti Fibromi sottomucosi (SM), dove per sottomucosi si intendono quelle formazioni che si sviluppano nel contesto del miometrio e in base alla percentuale di essi che aggetta nella cavità endometriale, vengono distinti in:
- G0 àsono totalmente intracavitari, non hanno rapporti se non per il peduncolo che li lega allo spessore del miometrio.
- GI meno del 50% è intramurale àquindi più del loro 50% aggetta dentro la cavità endometriale
- GII se più del 50% è intramurale àquasi del tutto intramurali, ovvero nel contesto dello spessore della parete, ma che un po’ aggettano verso la cavità endometriale.
Questi 3 ovviamente sono i tipi di fibromi che più spesso si associano a sanguinamento uterino anomalo.
Seguono i cosiddetti Fibromi intramurali e quelli Sottosierosi che invece sono quelli che sporgono sì, ma verso la sierosa uterina, quindi verso la cavità pelvica, non più verso quella endometriale.
Si distinguono in :
- Tipo 5 se sono più intramurali ( >50%) e con un po’ di spessore nella pelvi
- Tipo 6 aggetta per più del 50% verso la pelvi quindi sono intramurali per <50%
- Tipo 7 è un sottosieroso peduncolato che non ha nessun rapporto con la cavità uterina e non potrà essere ovviamente causa di sanguinamenti uterini anomali.
- Tipo 8 identifica tutti quelli che hanno delle localizzazioni anomale (cervicale, parassitica)
Questo sforzo di classificazione numerica è stato fatto ancora una volta per cercare di far avere alle pazienti un referto ecografico che possa essere interpretato in tutto il mondo allo stesso modo.
Perché i fibromi sottomucosi sono quelli che sanguinano di più?
Non solo per la loro posizione, quindi per il fatto che aggettano in cavità, ma anche perché addirittura si pensa che il fibroma sottomucoso sia un’altra entità clinica caratterizzata da tutta una serie di caratteristiche fenotipiche completamente diverse rispetto ai fibromi intramurali e sottosierosi.
Sulla base della loro localizzazione, delle caratteristiche istologiche e della risposta a farmaci ormonali, è sempre più plausibile la teoria che i miomi sottomucosi originano dalla zona giunzionale (JZ) del miometrio.
I miociti della JZ mostrano modificazioni cicliche dell’espressione dei recettori degli estrogeni e progesterone simili a quelle del ciclo ovarico. Sono inoltre caratterizzati da una maggiore densità cellulare, minore rapporto citoplasma/nucleo ed esprimono componenti di matrice differenti.
Esprimono inoltre concentrazioni significativamente maggiori di recettori EP. Mostrano alterazioni genetiche molto più frequenti i che in tutti gli altri tipi di miomi, a prescindere dalla loro dimensione. Questo può spiegare la loro modalità di crescita e la migliore risposta a farmaci ormonali.
Diagnosi per i fibromi
- Visita ginecologica la palpazione bimanuale, da un lato ci permette di apprezzare il collo dell’utero e con l’altra mano apprezziamo invece il fondo uterino. Ovviamente quando l’utero è di dimensioni aumentate noi sentiremo questo fondo che si sposta ad occupare la pelvi.
- Ecografia transaddominale e transvaginale il trasduttore della sonda arriva sul fornice posteriore, vicinissimo all’utero e riusciamo a studiarlo molto bene.
- Isteroscopia attraverso una sonda di pochissimi mm che entra all’interno della cavità endometriale, superando il canale cervicale, ci permette di vederla su di uno schermo.
- Sonoisterografia àa volte può sostituire o almeno, precedere, l’isteroscopia; prevede l’utilizzo di una ecografia vaginale dopo somministrazione di mdc intracavitario (acqua) che inserito dentro la cavità endometriale permette di vedere se ci sono formazioni che aggettano all’interno della cavità stessa.
NB: ovviamente l’isteroscopia è uno strumento diagnostico ma può anche diventare immediatamente uno strumento terapeutico; la sonoisteroscopia chiaramente no, al limite può essere il primo passo; tuttavia, nei centri in cui l’isteroscopia si fa di routine, non si fa il passaggio di una sonoistero prima.
- RMNàda riservare ai casi sospetti o particolarmente complessi.
Trattamento dei i fibromi uterini
I fibromi uterini sono spesso causa di indicazione all’intervento chirurgico in maniera inappropriata. In realtà, dovremmo trattare solo quello che è sintoamatico, solo la patologia.
Il fibroma è da considerarsi sempre una patologia?
“Si definisce patologia un’alterazione dello stato fisiologico e psicologico dell’organismo, capace di ridurre, modificare negativamente o persino eliminare le funzionalità normali del corpo”.
E quando il fibroma va considerato una patologia?
quando è un Fibroma SINTOMATICO.
NB: potremmo anche omettere di dire alla paziente che abbiamo visto un fibroma di piccole dimensioni (es: 2 cm e lontano dalla cavità), che noi sappiamo per esperienza che non darà mai problemi a questa donna, evitando di farla allarmare inutilmente. Se decidiamo di refertare e di dirlo alla paziente, dobbiamo essere in grado di far capire alla paziente che probabilmente lei convivrà per il resto dei suoi giorni con questo fibroma senza nessun problema.
Tuttavia, quando è sintomatico, dovremo gestire e decidere qual è il trattamento più indicato per la singola paziente.
- Più del 50% delle pazienti affette da fibroma sono (e probabilmente resteranno) asintomatiche
- In pazienti sintomatiche, i sintomi più comuni sono:
- Sanguinamento Uterino Anomalo
- Infertilità e sub fertilità
- Senso di peso pelvico e sintomi da compressione (per fibromi molto grandi)
Come facciamo ad identificare la sottopopolazione di pazienti con miomi che necessitano di trattamento? Abbiamo bisogno di una serie di informazioni:
- Anamnesi età, parità, eventuale desiderio riproduttivo e sintomi.
- ETV numero, dimensione e localizzazione dei miomi. Perché se il fibroma è singolo ha più senso pensare ad un intervento chirurgico, ma se sono multipli non avrebbe alcun senso toglierli uno per uno, in quel caso l’intervento non potrà che essere una isterectomia.
Mentre sapere la localizzazione è importante perché dobbiamo decidere la modalità d’accesso, non potremmo mai operare in laparoscopia un fibroma totalmente intracavitario, ne tantomeno potremmo pensare di togliere in isteroscopia o resettoscopia un fibroma che sporge soprattutto dentro il miometrio.
- Valutazione basale: Hb, Ferritinemia, OvAge in fase follicolare precoce(I-III giorno del ciclo) Il mioma è causa di anemia??
- Quanto è lontana la menopausa? Informazione importate perché in menopausa i fibromi tendono a regredire spontaneamente, quindi potremmo dire che la menopausa è la migliore delle terapie.
- Ma se una paziente si presenta a 40 anni, con età ovarica corrispondente all’età anagrafica, quindi non ci si aspetta la menopausa prima di 10-11 anni, non possiamo dire alla paziente di aspettare la menopausa se essa è sintomatica.
- Isteroscopia ambulatoriale Il mioma sporge in cavità??
Capiamo bene che tutti i tipi di trattamento che abbiamo a disposizione non possono prescindere da questo groviglio di valutazioni che stanno alla base.
- s L’isterectomia sarà l’intervento di scelta in pazienti con fibromi multipli e lontane dalla menopausa con sintomatologia che non riusciamo a gestire da un punto di vista medico.
- s La Miomectomia singola è invece di scelta nelle pazienti che hanno un fibroma singolo e che hanno magari un desiderio riproduttivo.
- s La Terapia medica è indicata in quelle pazienti in cui immaginiamo di poter almeno fare un tentativo per cercare di ridurre le dimensioni di questi fibromi. Oggi abbiamo degli strumenti molto efficaci per farlo, fino anche a fare quello che si chiama “preservazione del miometrio” , infatti a volte ci sono dei fibromi che noi riusciamo a far ridurre talmente tanto di dimensioni da fare scomparire la sintomatologia.
Rischi operatori nei casi di intervento sui sanguinamenti uterini anomali
Tutti gli interventi chirurgici, anche meno invasi e fatti da operatori esperti hanno sempre dei rischi legati all’intervento stesso che nel nostro caso saranno rappresentati ad esempio da:
- Emorragia intraoperatoria
- Sviluppo di aderenze postoperatorieinevitabili; minori in laparoscopia e maggiori in laparotomia ma pur sempre inevitabili.
- Rischio di rottura d’uteroin pazienti che successivamente hanno una gravidanza, soprattutto nel caso di miomectomie multiple. Questa evenienza può avvenire non solo durante il travaglio, ma anche in epoca precoce e in questo caso rappresentano una condanna a morte non solo per il bambino ma anche per la madre.
- Rischio di ricorrenza del mioma
Benefici di intervento sui sanguinamenti uterini anomali
Dall’altro lato, i benefici del trattamento chirurgico sono:
- Risoluzione della sintomatologia
- Aumento della fertilità
Dobbiamo stare attenti come, quando e a chi, fare questi interventi.
Ma vediamo quali sono oggi le vere indicazioni cliniche alla miomectomia, quindi all’asportazione del singolo fibroma: Miomectomia indicazioni “cliniche”
- Sanguinamento uterino anomalo (AUB) non responsivo a terapia medica
- Infertilità o abortività ricorrente per distorsione della cavità endometriale a causa di un fibroma che sporge in cavità (NB: qualcosa che sporge in cavità si comporta proprio come una spirale perché ovviamente essendo dentro il sito di impianto, rappresenta un meccanismo che ostacola l’impianto stesso). Diverso è il caso di fibromi che non sporgono in cavità, in cui possiamo stare tranquilli nel caso di una paziente che stia cercando una gravidanza.
- Forte sospetto di trasformazione maligna.
- Dolore pelvico o sintomi da compressione che interferiscono con la qualità di vita della paziente.
Quello che è certo è che per i fibromi sottomucosi, la terapia di scelta è la RESETTOSCOPIA, intervento di asportazione per via vaginale.
Quando il fibroma è singolo, il tasso di successo di questa tecnica va dal 70 al 99% e il tasso di recidive è basso. Contrariamente, se sporgono due fibromi, non c’è più l’indicazione a fare un intervento conservativo ma l’intervento di scelta sarà quello di asportazione dell’utero.
Fondamentale e sacrosanto è che questa paziente che deve andare a fare una resettoscopia, arrivi in sala operatoria dopo una adeguata preparazione medica, dove per preparazione medica noi intendiamo la somministrazione di un analogo del GnRH da 11,25 quando abbiamo una lista d’attesa che non ci permette di operare la paziente dopo un mese; quando invece possiamo operarla in tempi abbastanza rapidi, può essere sufficiente un 3,75. L’analogo da 11,25 induce uno stato di menopausa farmacologica per cui l’ipoestrogenismo determina una riduzione dello spessore e della vascolarizzazione dell’endometrio e inoltre riduce il rischio di sanguinamento durante l’intervento resettoscopico di queste pazienti.
- NB (1): una pazente che deve fare una resettoscopia o una miomectomia laparoscopica, va sempre preparata con un azzeramento medico prima dell’intervento perché si riducono le complicanze.
- NB (2):l’analogo del GnRH da 3,75 ha una durata mensile mentre l’11,25 ha una durata bimestrale.
Sospetto sarcoma uterino
Il sarcoma uterino è una neoplasia ginecologica molto rara (1.7 ogni 100.000 donne di età superiore a 20 anni). È un tumore del tessuto uterino ad altissima mortalità anche perché la diagnosi spesso è tardiva. Infatti, la diagnosi pre operatoria di leiomiosarcoma è difficile da eseguirsi.
I criteri di sospetto diagnostico sono:
- Rapido accrescimento, soprattutto in pazienti in post-menopausa (in generale infatti i fibromi in post menopausa regrediscono)
- Vascolarizzazione centrale con bassi indici di resistenza
- Aumento sierico LDH isoenzimi 3, 4 e 5
Essere in grado di stratificare preventivamente il rischio di sarcoma permette al chirurgo di decidere la strategia chirurgica più adatta.
Nel caso di sospetto clinico, e mai come indagine di primo livello, si può indirizzare la paziente verso una RMN.
l’impatto del fibroma su Infertilità e subfertilità
L’impatto dei fibromi sulla fertilità è controverso. Di solito è difficile che il fibroma da solo possa essere la causa dell’infertilità mentre di solito fa parte di un contesto in cui sono presenti anche altre cause.
Mioma → unico fattore di infertilità → solo 2-3% dei casi.
Nessuna evidenza di riduzione dei tassi di gravidanza in caso di miomi intramurali (OR 1.88, 95% CI 0.57 to 6.14), sottomucosi(OR 2.04, 95% CI 0.62 to 6.66), combinati intramurali e sottosierosi(OR 2.00, 95% CI 0.40 to 10.09) e combinati intramurali e sottomucosi(OR 3.24, 95% CI 0.72 to 14.57)
Pazienti con miomi intramurali o sottosierosi <4 cm che non distorcono la cavità hanno outcomes IVF-ICSI comparabili a quelli di pazienti senza miomi. Pertanto, essi non dovrebbero sottoporsi a miomectomia prima di cicli di riproduzione assistita.
Quindi non operiamo mai una paziente che ha un fibroma che non sporge in cavità.
Quale tipo di intervento dobbiamo scegliere?
Ovviamente se è possibile, si opta sempre per quello meno invasivo possibile, quindi quello laparoscopico rappresenta il gold standard soprattuto nelle pazienti che vengono operate per l’infertilità, poiché dobbiamo cercare di mantenere il più possibile l’anatomia pelvica.
Talvolta, quando l’intervento laparoscopico si preannuncia troppo difficile o troppo lungo (come ad esempio per fibromi che superano i 6-7 cm), o ancora, quando la localizzazione di questo fibroma è angusta da raggiungere per via laparoscopica (ad esempio se si tratta di fibromi posteriori molto bassi, molto vicini al collo dell’utero) allora, in quel caso l’operatore che sa di non essere molto esperto in laparoscopia può propendere verso un intervento che è una via di mezzo tra l’invasività della laparoscopia e quella della laparotomia e che si chiama appunto, MINILAPAROTOMIA. Questo intervento, utilizza un’incisione chirurgica molto ridotta (inferiore a 4-5 cm) che permette però l’esposizione del campo operatorio e quindi permette di mantenere i vantaggi della mininvasività della laparoscopia con i vantaggi della facilità chirurgica della laparotomia.
L’approccio minilaparotomico è stato confrontato con quello laparotomico e si è visto che comunque c’è una riduzione della perdita ematica intraoperatoria, riduzione dei tassi di ileo post-operatorio e riduzione dei giorni di degenza.
Terapia medica
Quello che ha cambiato radicalmente la pratica medica negli ultimi 5 anni è l’immissione in commercio di un nuovo farmaco l’ULIPRISTAL ACETATO (UPA), nome commerciale ESMYA®. Esso è un modulatore selettivo del recettore del progesterone (SPRMs).
Gli SPRMs sono composti steroidei o non steroidei che legano i recettori del progesterone, modulando la trascrizione in maniera positiva o negativa, con una conseguente modulazione tessuto-specifica. Gli SPRMs si comportano sia come agonisti del progesterone che come antagonisti, in base al tessuto target.
Il progesterone, come gli estrogeni, è un fattore chiave nella patogenesi dei miomi, come dimostrato dalla maggiore espressione di recettori del progesterone A e B nelle cellule del fibroma comparate al circostante miometrio.
Questo farmaco ha un meccanismo d’azione totalmente diverso dall’analogo del GnRH, che andava ad indurre quello stato di menopausa farmacologica che tanto ci preoccupa perché si associa a diverse complicanze a lungo termine.
Questo farmaco invece, va ad avere una azione selettiva sui recettori del progesterone dei fibromi uterini ànon ha nessun effetto sugli altri recettori né sulla mammella, quindi è estremamente selettivo per i recettori presenti all’interno della formazione miomatosa.
Ha una azione:
- Diretta sull’attività progestinica di crescita di questi fibromi
- Indiretta a livello ipofisario con riduzione di FSH, LH temporanea che non si associa ad ipoestrogenismo.
Per cui si ha una aumentata sensibilità al progesterone, che abbiamo detto “differenzia”, però mantenendo dei livelli estrogenici comunque medio-bassi ma tali da non fare avvertire alla paziente i sintomi da deprivazione estrogenica tipici della menopausa.
èQuindi si mantengono dei livelli di estrogeni minimi sufficienti al benessere della paziente, sia come sintomatologia sia come effetto a lungo termine.
Il grosso vantaggio della terapia con l’Ulipristal è, oltre alla facile somminitrazione (compressa per os), la velocità di riduzione del sanguinamento estremamente maggiore rispetto all’analogo. Di solito pazienti con sanguinamento uterino eccessivo già dopo le prime 2-3 compresse, quindi dopo i primi 2-3 giorni hanno una riduzione del flusso statisticamente significativo. Inoltre questa riduzione del flusso, si mantiene per più tempo anche dopo la fine della terapia sempre rispetto all’efficacia dell’analogo.
Ovviamente oltre che per la riduzione del flusso, che spesso è la cosa più importante ma non l’unica, l’Ulipristal si è dimostrato efficacie anche nella riduzione delle dimensioni di questi fibromi. Ancora una volta si è visto che, sia l’Ulipristal che l’analogo sono efficaci nella riduzione delle dimensioni, però, la riduzione apportata dall’Ulipristal si mantiene per più tempo rispetto al follow up delle pazienti che erano state trattate con l’analogo.
Quindi questo è un farmaco che oggi utilizziamo tantissimo e che addirittura all’inizio si poteva fare solo per 3 mesi, poi è stato autorizzato per 2 cicli da 3 mesi con una sospensione di 2 mestruazioni e mezzo ed oggi addirittura siamo arrivati all’utilizzo per 4 cicli da 3 mesi con sempre i due mesi di pausa tra un ciclo e l’altro. In realtà già ci sono degli studi di sicurezza pubblicati per cui si è visto che si possono fare anche 4 cicli ripetuti. Questa cosa ci serve perché nella paziente in cui la distanza dalla menopausa è inferiore a 2 anni noi oggi riusciamo a gestire la presenza di una sintomatologia anche importante garantendo alla paziente il benessere, accompagnando questa paziente fino alla menopausa e senza la necessità di un intervento chirurgico. ESMYA ha veramente ridotto in maniera significativa il numero di interventi chirurgici per questa patologia negli ultimi 2-3 anni e questo dato andrà ad aumentare in quanto sarà possibile trattare le paziente per periodi sempre più lunghi. Perché non lo facciamo subito? Perché questo farmaco ha degli effetti sull’endometrio che per quanto transitori vanno tenuti sott’occhio. Infatti l’utilizzo del farmaco determina lo sviluppo dei cosiddetti PAEC, che non sono altro che un’alterazione microscopica delle cellule endometriali che noi ecograficamente vediamo come un inspessimento endometriale. Siccome si tratta di un farmaco nuovo, ovviamente si stanno facendo degli studi per garantire che questi PAEC siano effettivamente sempre regredibili dopo la sospensione del farmaco e non determinino mai un rischio oncologico per lo sviluppo di cancro dell’endometrio per queste pazienti.
Nelle flow chart per come dobbiamo comportarci ogni volta, adattando la strategia terapeutica alla specifica paziente:
A. HMB e menopausa lontana: ad esempio, nella paziente senza desiderio riproduttivo, cosa facciamo? Vediamo se la menopausa è vicina. Se quest’ultima è lontana dobbiamo fare una isteroscopia perché
- se la cavità è distorta: possiamo provare ad usare il farmaco per cercare di ridurre le dimensioni e fare in modo che questo fibroma non sporga più in cavità;
- se invece la cavità non è distorta: a quel punto noi possiamo pensare di fare Esmya a lungo termine, oppure mettere dentro l’utero della paziente una spirale medicata al progesterone che ha un effetto, essendo un farmaco progestinico, di ridurre il sanguinamento di queste pazienti. La spirale chiaramente si può mettere solo se la cavità non è distorta, perché se è distorta la spirale nel 90% dei casi verrà espulsa; se invece non è distorta è una terapia a lungo termine che per 5 anni fa stare la paziente veramente molto bene.
B. HMB, miomi multipli e\o sottomucosi: abbiamo detto che nel caso di fibromi multipli e\o sottomucosi non possiamo fare l’intervento e allora proviamo a fare la terapia medica.
C. HMB, mioma sottomucoso singolo: quando il fibroma è singolo, c’è un sanguinamento e sporge in cavità, abbiamo detto che il gold standard è la preparazione con l’analogo del GnRH e la resettoscopia.
Condizioni maligne e pre-maligne (AUB-M)
Nella valutazione di una pazienti con AUB, soprattutto in epoca perimenopausale, è possibile che in seguito a biopsia endometriale si diagnostichi la presenza di iperplasia endometriale atipica o carcinoma endometriale.In queste circostanze, la pazienti è categorizzata come AUB-M e trattata secondo le line guida FIGO e NCCN per il carcinoma endometriale.
Cause non organiche di AUB
Coaugopatie – (AUB-C)
Sebbene esista una grande varietà di disturbi dell’emostasi (coagulopatie), la più comune di queste è la malattia di von Willebrand, che in studi appropriatamente disegnati è stata diagnosticata nel 13% delle donne con sintomi di HMB. Nel momento in cui facciamo una ecografia alla paziente e non troviamo nessuna causa organica, la prima cosa a cui dobbiamo pensare è che questa paziente possa avere un’alterazione della coagulazione. Tuttavia, la presenza di coagulopatie è spesso sottostimata dai medici che trattano le pazienti con HMB. La presenza di coagulopatie è spesso sottostimata anche dagli studi clinici condotto su pazienti con HMB.
Circa il 90% di queste pazienti può essere facilmente riconosciuto attraverso una anamnesi accurata, un dosaggio del fattore di von Willebrand e una valutazione della coagulazione completa.
Tutte le pazienti con AUB dovrebbero pertanto essere screenate per questi disordini prima di essere sottoposte a procedure diagnostiche invasive.
Disfunzioni ovulatorie – (AUB-O)
Le donne con disfunzioni ovulatorie di norma presentano alcune combinazioni di AUB, soprattutto in termini di regolarità e volume, che in alcuni casi si presenta aumentato. Più spesso gli AUB-O sono di tipo anovulatorio e conseguente ridotta e irregolare frequenza di sanguinamento.
Le cisti ovariche funzionali a secondo che siano di tipo follicolare o luteinico, producendo estrogeni o progesterone seppure in maniera transitoria, ma in eccesso, sono causa di sanguinamento uterino anomalo. Infatti ad esempio, la paziente che ha cisti follicolare che produce estrogeni ci racconterà che ha saltato una mestruazione o che ha un ciclo infrequente, irregolare, improvvisamente. La paziente che invece ha la cisti luteinica, che abbiamo detto produce progesterone, avrà un ciclo anomalo per quantità.
Sebbene la maggior parte dei disturbi dell’ovulazione non hanno una genesi specifica, nelle donne in epoca riproduttiva possono essere dovuti ad endocrinopatie (e.g. PCOS, ipotiroidismo, iper-PRL, stress, obesità, anoressia, esercizio fisico estremo), o da causa iatrogena (farmaci steroidei ; o i FANS che determinano irregolarità mestruali poiché inibiscono i fenomeni dell’ovulazione stessa).
Endometriale (AUB-E)
“E” sta per quelle cause che prima venivano classificate come disfunzionali e che sono quelle cause cosiddette endometriali intrinseche.
Quando l’AUB si presenta nel contesto di cicli mestruali regolari, tipicamente in caso di cicli ovulatori, quando nessuna altra causa organica o funzionale è rinvenuta, il meccanismo è probabilmente un disordine primario degli eventi regolatori l’emostasi endometriale locale.
- Riduzione della produzione locale di vasocostrittori, quali endothelin-1 e prostaglandin F2alfa
- Eccessiva produzione dell’attivatore del plasminogeno
- Aumentata produzione di sostanze vasodilatatrici, quali prostaglandina E2 e prostaciclina (I2)
Anche infezioni (Chlamydia Thachomatis) o infiammazioni endometriali, insieme ad anomalie della vascolarizzazione endometriale sono cause infrequenti di AUB.
NB: Questa è più che altro una diagnosi di esclusione, non abbiamo dei criteri diagnostici per dire che quello che abbiamo davanti è un AUB da causa endometriale.
Iatrogena (AUB-I)
Sanguinamenti uterini non programmati possono verificarsi nel corso di terapie con:
- Ormoni steroidei (eg, estrogens, progestogens, androgens)
- Terapie ormono-simili (eg, GnRh, aromatase inhibitors, SERMs sPRMS,)
Uso errato di EP, dimenticanze nell’assunzione, fumo di sigaretta, interazione con atri farmaci, malassorbimenti. AUB frequenti nei primi 3-6 mesi dopo l’inserimento di LNG-IUS. HMB è una complicanza comune dell’uso di anticoagulanti qualiwarfarin, heparin, and low molecular weight heparin.
Non ancora classificato (AUB-N)
Condizioni cliniche, quali endometriti croniche, malformazioni arteriovenose, iperplasia miometriale, alcune condizioni sistemiche poco definite, mal diagnosticabili o entrambi.
Algoritmo diagnostico
La FIGO ha cercato di creare un algoritmo diagnostico per cui: nel momento in cui si fa una prima valutazione uterina, prima di tutto bisogna capire se c’è un rischio di neoplasia. Nel caso in cui ci fosse, bisogna subito fare una biopsia endometriale. Invece, nel caso in cui si evidenzia la presenza di una patologia che altera la struttura, viene suggerito di fare inizialmente una eco transvaginale più o meno associata ad isteroscopia con biopsia o a una sonoisteroscopia.
Qual è il work-up diagnostico che noi utilizziamo di routine?
- Valutazione dei sintomi (emocromo e ferritinemia)
- Eco tv
- Età ovarica
Tutto questo da fare entro il III giorno del ciclo.
La paziente che viene da noi per la prima volta viene sottoposta ad una ecografia e vediamo se c’è una causa organica, inoltre indichiamo di andare a fare gli esami che servono per calcolare l’età ovarica oltre che l’emocromo e la ferritinemia, il tutto entro il prossimo ciclo mestruale.
Nel caso in cui sia indicata l’isteroscopia, già la volta successiva questa paziente eseguirà una isteroscopia per andare a vedere la presenza o meno di sporgenza di un eventuale fibroma.
L’isteroscopia ci permetterà poi di decidere tra quello che è il successivo management:
- Follow up
- MIRENA® (spirale medicata)
- UPA
- Ablazione endometrialeàoggi si usa molto poco. Prevede l’asportazione o attraverso una procedura chirurgica, oppure attraverso dei palloncini che bruciano dall’interno della cavità il tessuto endometriale. Si usava soprattutto prima, quando non vi era ancora molta terapia medica, in pazienti con ripetuti casi di iperplasia endometriale. Quindi non per il singolo polipo ma per una proliferazione disomogenea che interessava tutta la cavità uterina, in pazienti senza desiderio riproduttivo e vicine alla menopausa. Oggi questa procedura si è abbandonata perché difficilmente si riesce ad essere precisi nell’asportazione di tutte le cellule endometriali e quel poco che rimane può risentire delle influenze cicliche mensili e sanguinare ugualmente.
- Miomectomia\ resettoscopia
- TLH con eventuale conservazione ovarica.