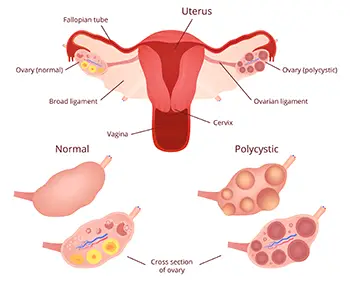
Ovaio Policistico – Iperandrogenismo
L’iperandrogenismo o eccesso androgenico rappresenta la più comune endocrinpatia riproduttiva, con una prevalenza del 5-10% delle donne in età fertile.
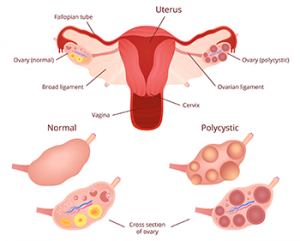
Ovaio Policistico – dal punto di vista clinico
- Irsutismo: aumento della peluriain distretti dove, normalmente, i peli non dovrebbero esserci;
- Acne;
- Virilizzazione: alopecia, abbassamento del timbro di voce, clitoridomegalia, aumento della massa muscolare;
- Anovulatorietà: infertilità, oligo/amenorrea, possibile iperplasia endometriale, etipie e carcinoma endometriale.
Ovaio Policistico – dal punto di vista laboratoristico
- Livelli elevati di testosterone libero;
- Livelli elevati di testosterone totale;
- Livelli elevati di androstenedione;
- Livelli elevati di DHEA-S
Cause principali di Iperandrogenismo
- Sindrome dell’ovaio policistico, è in assoluto la più frequente
- Iperandrogenismo idiopatico, cioè donne che hanno sintomi di iperandrogenismo (irsutismo, in particolare) ma non se ne conosce la causa
- Iperplasia surrenalica non classica, cioè il deficit congenito di 21 idrossilasi non classico
- Tumori secernenti androgeni, molto raramente.
Sindrome dell’ Ovaio Policistico (PCOS)
La PCOS è molto diffusa tanto che, se ci ragioniamo sopra, sorge un grande dubbio: trattandosi di una patologia che nella donna riduce in maniera importante la fitness riproduttiva (concetto secondo cui il più forte sopravvive) a causa dell’anovulatorietà, com’è possibile che questo genotipo/fenotipo sia così diffuso nella popolazione? Probabilmente, queste sono donne che, in condizioni particolari, hanno una fitness riproduttiva migliore. Quando? Vedremo che molto diffusa fra queste donne è l’insulino-resistenza, in altre parole queste, probabilmente, rappresentano una sorta di “dfriting genotypic” capaci di riprodursi anche in condizioni di ridotto apporto calorico (potrebbe essere una spiegazione).
Comunque, la prevalenza in Italia è del 25-30%, d’altro canto il 65-85% delle donne con iperandrogenismo ha una diagnosi di PCOS.
Ovaio Policistico – Clinica
- Irregolarità mestruali
- Irsutismo
- Obesità e distribuzione centrale del grasso
- Infertilità
- Acne
- Alopecia androgenica
- Apnea ostruttiva notturna
- Acanthosis nigricans
- Ovaie policistiche
Ovaio Policistico – Criteri diagnostici
- Criteri NICHD: devono essere presenti iperandrogenismo e anovulazione cronica
- Criteri di Rotterdam(2003): devono essere presenti due delle condizioni fra iperandrogenismo, anovulazione cronica ed ovaio policistico (PCO), avendo escluso altre patologie
- Criteri dell’Androgen Excess Society: deve essere necessariamente presente l’iperandrogenismo, più la disfunzione ovarica indicata o da una oligo-/anovulazione o dall’aspetto policistico delle ovaie.
Per fare diagnosi di PCOS in una donna con iperandrogenismo, bisogna innanzitutto escludere altre patologie quali:
Iperprolattinemia
Deficit congenito di 21 idrossilasi non classico: L‘iperplasia surrenalica congenita non classicaèuna forma post-puberale attenuata, acquisita late onset (cioè dopo la pubertà). Si tratta di una malattia genetica a trasmissione autosomica recessiva, legata al deficit enzimatico di 21 idrossilasi (più frequentemente), di 11-β idrossilasi o di 3β-HSD (più raramente).
La 21 idrossilasi è un enzima limitante nella sintesi dei corticosteroidi. Se non funziona, si accumulano i precursori del cortisolo cioè il 17-OH progesterone e l’androstenedione, determinando irsutismo, acne, oligo e/o amenorrea, aspetti ecografici PCOS-like. Per capire se c’è un deficit di questo enzima, si va a dosare il 17-OH progesterone. Se è > 4 ng/ml c’è sicuramente il deficit, se è compreso tra 2 e 4 ng/ml per avere la conferma, faccio un test da stimolo con ACTH: se il 17-OH progesterone aumenta ed il cortisolo non aumenta vuol dire che c’è il deficit.
disfunzionetiroidea
- Neoplasie androgeno-secernenti: tumori virilizzanti, più frequentemente si tratta di tumori surrenalici, tumori ovarici o adenomi ipofisari. Questi dovrebbero essere sospettati ogni qualvolta l’insorgenza dell’iperandrogenismo è improvvisa e a rapida progressione o quando è presente una franca virilizzazione. Vanno esclusi, inizialmente, con un dosaggio del testosterone: se l’androgeno è < 8 ng/l, difficilmente avremo un tumore androgeno-secernente. Invece, con un valore molto alto, vale la pena andare a controllare le ovaie;
- Sindrome di Cushing: è un termine generico che fa riferimento ad uno stato clinico derivante da una prolungata ed abnorme esposizione ad un eccesso di cortisolo. Si distinguono:
- Forme ACTH-dipendenti-> aumentata secrezione ipofisaria o ectopica di ACTH (85% dei casi)
- Forme ACTH-indipendenti-> iperproduzione autonoma di cortisolo da parte del surrene.
Per verificare che non si tratti di questa sindrome si fa il test di sopressione con desametasone;
- Sindrome HAIRAN(Hyperandrogenism Insulin Resistance Acanthosis Nigricans): insieme eterogeneo di sindromi, spesso ereditarie, associate ad anomalie severe dell’azione insulinica:un difetto recettoriale e post-recettoriale dei recettori insulinici determina un maggiore grado di insulino-resistenza ed iperinsulinismo compensatorio, rispetto alla PCOS. Infatti, per escludere che si tratti di Sindrome HAIRAN, si ricerca la presenza di acantosi (pelle con l’aspetto di velluto e di colore scuro, a causa dell’azione dell’eccesso di insulina sulla cute), legata appunto ad un maggior grado di insulino-resistenza e si effettua un dosaggio basale di insulina che, in questa sindrome, è >80 IU/l;
- Iperandrogenismo iatrogeno: La somministrazione di farmaci può indurre sintomi da iperandrogenismo attraverso due meccanismi:
-
-
-
- Aumento dei livelli circolanti di androgeni.
- Attività androgenica intrinseca del farmaco
-
-
- Irsutismo idiopatico: il 15-30% delle donne con irsutismo non presenta alcuna alterazione particolare.
Un ovaio policistico all’ecografia è un ovaio che presenta 12 o più follicoli di 2-9 mm in ciascun ovaio e/o un aumento del volume ovarico > 10 ml. Quest’ultimo parametro rafforza la diagnosi, ma non è più considerato un criterio indispensabile.
Ci sono questi follicoli piccolini che sono follicoli pre-antrali ed antrali (diametro compreso tra 2 e 8 mm) e al centro c’è un’iper-rappresentazione dello stroma ovarico.
Differenza tra donne con ovaie policistiche e quelle con ovaie normali
Le due grandi differenze tra le donne con ovaie normali e quelle con ovaie policistiche, sono:
- L’aumentato numero di follicoli terziari
- Quantità di stroma presente sulla sezione di taglio
Per secoli, la diagnosi di PCO si faceva solo attraverso la laparotomia. Fra le prime descrizioni ci fu quella di Malpighi che descrisse una donna sterile, obesa, con mestruazioni irregolari che muore e lui, facendone l’autopsia, rinviene queste ovaie ingrossate, bianche e policistiche.
Attraverso la finestra vescicale si vede l’ovaio che è policistico, con l’addensamento stromale e tutti i follicoli attorno.
Un ulteriore passo avanti nella diagnosi lo si fa quado si passa all’ecogafria transvaginale che risulta essere più vantaggiosa dell’ecografia transaddominale perchè, come sappiamo, se quanto maggiore è la frequenza degli ultrasuoni che utilizziamo, tanto maggiore è la capacità di discernere due punti come separati fra loro è vero anche che, quanto più alta è la frequenza, tanto minore è la capacità che hanno di penetrare. Con la sonda transvaginale, invece, attraverso la cavità vaginale si mette la sonda direttamente a contatto con l’ovaio.
In condizioni normali abbiamo l’endometrio che è preparato dagli estrogeni e dal progesterone, ad un certo punto il corpo luteo scompare e si realizzano la vasocostrizione e la lisi enzimatica: entrambi questi eventi concorrono alla mestruazione che è autolimitante proprio grazie alla vasocostrizione.
Nelle donne anovulatorie, come quelle affette da PCOS, la stimolazione estrogenica è prolungata e vi è assenza di attività progestinica: l’endometrio è ispessito ed intensamente vascolarizzato, privo di una matrice stromale di supporto.
Questo endometrio, dopo un pò di tempo, va in contro a sanguinamento spontaneo, per cui la donna con PCOS non è in amenorrea ma riferisce mestruazioni irregolari. Un sanguinamento di questo tipo, che è detto da “rottura estrogenica” non interessa tutto l’endometrio contemporaneamente, c’è assenza di vasocostrizione ed interessa un tessuto instabile. Non solo, alla fase proliferativa prolungata fa seguito l’iperplasia semplice, poi l’iperplasia complessa e su quest’ultima, in alcuni casi e con meccanismi che non sono ancora oggi chiari, si può instaurare un’iperplasia atipica che porta, poi, al carcinoma dell’endometrio.
Avrete già capito che la PCOS, in qualche modo, rappresenta un’altra sfaccettatura della sindrome metabolica: la ragazza che presenta acne, irsutismo, anovulazione non si preoccupa, vista la giovane età, della sindrome metabolica ma, nel tempo, potrà andare in contro all’insulino-resistenza, all’alterazione all’OGTT, al diabete di tipo 2, alla ipertensione e alla dislipidemia, quindi aumenta il fattore di rischio cardiovascolare.
Quindi le donne affette da PCOS sono a rischio aumentato di intolleranza glucidica, diabete gestazionale, diabete mellito di tipo 2 e patologie cardiovascolari.
Qual è il meccanismo dell’insulino-resistenza nelle donne affette da PCOS?
Si tratta di un meccanismo specifico di questa sindrome che consiste nell’iperfosforilazione dei residui serinici del recettore insulinico: una o più chinasi, ereditate in maniera dominante, fosforilano la serina sia di INS-Rα che del citocromo P450. Nel primo caso la conseguenza è l’insulino-resistenza, nel secondo l’iperandrogenismo.
Terapia per donne con Ovaio Policistico
Cosa possiamo fare per queste pazienti?
- Modificazione dello stile di vita: ridurre il consumo di caffè, di alcol, smettere di fumare, ridurre il distress psico-sociale, stabilire un deficit energetico di 500-1000 calorie al giorno. Modificazione della dieta con riduzione dell’apporto di grassi, soprattutto degli acidi grassi saturi e dei trans, riduzione del carico glicemico, aumentare le fibre e i grassi polinsaturi (sostanzialmente, la dieta mediterranea). Inoltre è consigliato un esercizio fisico intenso/moderato, a seconda dell’età della paziente, per facilitare il deficit calorico;
- Abbinare alla dieta ipocalorica il trattamento con flutamide e metformina: la metformina, normalizzando l’insulino-resistenza, ha un effetto sullo score dell’irsutismo, ma ha anche un importante effetto sulla regolarità delle mestruazioni. La flutamide (che è un antiandrogeno) ha effetto potentissimo sull’irsutismo, ma meno importante sulla frequenza delle mestruazioni. La combinazione dei due farmaciha un effetto valido nella terapia delle pazienti affette da PCOS;
- Contraccettivi orali (OCP): conducono ad una riduzione significativa dello score di Ferriman-Gallwey (che si utilizza per dare un punteggio all’irsutismo), ma sono meno efficaci della flutamide. Efficaci sono anche lo spironolattone, l’associazione ciproterone acetato e OCP, mentre la metformina e la finasteride sono un pò meno efficaci.
Quindi, attualmente, i contraccettivi ormonali risultano una terapia estremamente efficace per quanto riguarda l’aspetto cosmetico della sindrome.
Con che meccanismo i contraccettivi ormonali potrebbero migliorare il quadro del PCO?
- Inibiscono la secrezione ipofisaria di gonadotropinee vanno, quindi, a togliere quello stimolo all’ovaio a produrre androgeni;
- La quota di estrogeni (Etinilestradiolo, 30 mcg) presente nel contraccettivo ormonale attiva la sintesi epatica di SHBG (sex hormon binding globuli) che sequestra gli androgeni, impedendogli di agire;
- Inibisce la sintesi surrenalica di androgeni, con un meccanismo non ancora chiarito;
- I progestinici agiscono a livello della 5alfa-reduttasi e dei recettori androgenici. A tal proposito anche i progestinici cosiddetti androgenici (es. Levonorgestrel) hanno, a dosi elevate, attività antiandrogena.