Che cos’è il complemento
Il complemento è un fenomenale battericida formato da molecole plasmatiche.
Quali e quante sono le molecole che compongono il Complemento
Le molecole plasmatiche principali che compongono il Complemento sono 9:
- C1
- C2
- C3
- C4
- C5
- C6
- C7
- C8
- C9.
La molecola C1 a sua volta è suddivisa in:
- C1q
- C1r
- C1s
ed è presente in quantità maggiore delle altre nel sangue. Il processo di attivazione di queste molecole porta a una variazione di nomenclatura ponendo una linea sopra la molecola attivata.
L’attivazione del complesso è un fenomeno a cascata con amplificazione di passaggio in passaggio. Per le molecole da C2 a C5 da una singola molecola per attivazione proteolitica si ottengono due peptidi di dimensioni diverse contrassegnati con lettere a pedice: C2 darà C2a e C2b, e così via fino a C5.
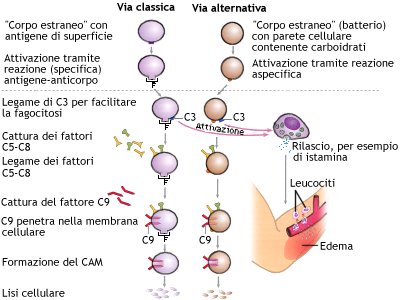
Le vie di attivazione del complemento
Esistono 3 vie di attivazione del complemento che dipendono dal tipo di risposta immunitaria dell’organismo:
- L’attivazione CLASSICA segue la risposta immunitaria acquisita in cui essendo l’organismo già venuto a contatto con il corredo antigenico dell’agente infettante dispone di anticorpi specifici circolanti necessari per l’attivazione della prima molecola del complemento.
- L’attivazione ALTERNATIVA invece segue la risposta immunitaria innata e quindi non necessita della presenza di anticorpi circolanti. È attivata da prodotti di parete o membrana batteriche (endotossine…) e da antigeni non-self.
- Ma può essere attivato anche se il sistema immunitario viene a contatto con un batterio. Il macrofago produce Il6 che va ad agire sul parenchima epatico stimolando la sintesi della Proteina che lega il Mannosio, che a sua volta va ad attivare il complemento.
Attivazione classica
Per l’attivazione classica è necessario che la molecola C1 venga in contatto con Immunoglobuline (IgG e IgM) specifiche per gli antigeni di superficie dell’agente infettante (batterio). Servono 2 IgG per ogni C1. Basta invece una sola IgM.
Complemento C1
C1 attiva prima C4 e poi C2 dividendo ognuno in 2 molecole. Un sola molecola C1 attiva più complessi C4 e C2 dando l’avvio alla prima amplificazione del processo.
C4a e C2b rimangono in soluzione.
C4b e C2a si uniscono a formare il complesso enzimatico C3-convertasi che si ancora alla membrana batterica e agisce sulla molecola C3lisandola in 2 molecole.
3a rimane in soluzione.
Complemento C3 attivazione classica
C3b può subire 2 sorti: rimanere in soluzione e quindi venire degradato, oppure associarsi al complesso C3-convertasi (C2aC4b) e formare il complesso C5-convertasi che si associa alla membrana batterica e agisce sulla molecola C5 lisandola i 2 molecole.
C5a rimane in soluzione.
C5b si associa prima alle molecole C6 e C7 e rimane in soluzione. Quando vi si associa anche C8 il complesso assume carattere insolubile e precipitando si aggancia alla membrana batterica formando un canale per le molecole C9 che, man mano che entrano si associano al complesso, allargano il lume del canale fino a provocare la lisi della cellula batterica.
Attivazione alternativa
Complemento C3 in attivazione alternativa
C3 in soluzione è una molecola instabile per natura chimica (…-Cys-Gln-…). È quindi in grado di autoattivarsi passando spontaneamente in forma C3’ e reagendo con la proteina plasmatica B.
Il fattore D interviene inducendo la scissione del fattore B in due parti, una delle quali rimane associata a C3’ e l’altra va in soluzione.
C3’Bb se non viene degradato agisce da C3-convertasi su C3 lisandolo nei suoi componenti.
Fin qui c’è stata la fase in soluzione del processo, in cui C3 autoattivandosi inizia un ciclo in cui diventa substrato e parte dell’enzima.
Se rimane in soluzione, C3b può essere degradato. Se invece si associa alla membrana cellulare innesca un circuito di amplificazione.
Si associa al fattore B.
Il fattore D interviene inducendo la scissione del fattore B.
Il complesso C3bBb è una C3-convertasi che agisce su un’altra molecola di C3 chiudendo un circolo in cui la scissione di C3 è amplificata.
L’amplificazione continua fino a quando una C3b si associa al complesso C3-convertasi formando un nuovo complesso C5-convertasi.
Regolazione del complemento
Si è osservato che eritrociti e altre cellule del sangue (cellule self) sono in qualche modo protetti dall’azione litica del complemento, e che tale azione è specie-specifica.
Devono esserci quindi dei meccanismi con i quali il complemento viene inattivato.
Questi meccanismi agiscono in varie maniere sulle molecole del complesso in soluzione:
- nel sangue ci sono proteine che impediscono alle molecole C9 di interagire con l’insieme C5bC6C7C8 e quindi di allargare il canale che provocherebbe la lisi cella cellula
è presente nel sangue una serina-proteasi che inibisce C1
è presente un fattore I che catabolizza (distrugge) il C4 in soluzione - ma ci sono meccanismi che agiscono anche sulle molecole del complesso associate alla membrana (convertasi), in fase solida:
DAF, una proteina di membrana, inibisce l’associazione di C4b con C2
DAF stimola anche la dissociazione di C4b da C2
Il fattore I catabolizza C4b associato alla membrana
L’attivazione del complemento però può anche essere facilitata da strutture presenti sulla superficie cellulare batterica come lo strato protettivo della parete batterica che agevola l’ancoraggio delle molecole del complemento.
Alcuni batteri possono difendersi esponendo sulla superficie recettori che competendo con C1 nell’ancoraggio alle immunoglobuline non permettono la sua attivazione e quindi bloccano sul nascere l’attivazione per via classica del complemento.
Azione del complemento
Le Anafilotossine C3a C4a e C5a sono mediatori vascolo-essudativi dell’infiammazione acuta che attivano i leucociti neutrofili e basofili e i monociti portandoli alla formazione e rilascio di citochine (Il1 e Il2), aumentano la permeabilità dei vasi, hanno effetto vasodilatante e stimolano la kemiotassi.
Il Fattore opsonizzante C3b
Il Fattore opsonizzante C3b si associa sia a recettori di membrana dei batteri che a recettori di membrana delle cellule fagocitarie (come fosse una Ig). In questo modo facilita la fagocitosi e la digestione dell’agente infettante.