Gli oncogeni sono forme alterate di geni chiamati proto-oncogeni. I proto-oncogeni, le cui forme mutate sono coinvolte nella genesi dei tumori umani, sono spesso localizzati in vicinanza di punti in cui si verificano frequentemente rotture cromosomiche o in siti che rappresentano un bersaglio elettivo di mutazioni. Studi su traslocazione cromosomiche non random, hanno reso possibile la scoperta di oncogeni attivati in seguito a queste traslocazione. Ad esempio nel linfoma di Burkitt si verifica una traslocazione 8-14 e il gene myc viene sovra espresso.
Proto oncogeni
I proto-oncogeni sono trasmessi come caratteri mendeliani classici (ma le forme mutate, gli oncogeni, non sono trasmissibili), sono conservati filogeneticamente, sono circa un centinaio e il loro prodotto proteico è funzionale alla proliferazione ed alla differenziazione cellulare.
Le proteine codificate dai proto-oncogeni possono essere:
- Fattori di crescita;
- recettori per fattori di crescita;
- fattori di trascrizione;
- proteine pro o anti apoptotiche.
Alcuni tipi di proto-oncogeni:
- BCL-1 = ciclina D1;
- BCL-2 = proteina anti-apoptotica;
- BCR = fattore attivante la funzione GTPasica delle proteine G;
- MET = recettore per il fattore di crescita degli epatociti.
Da proto-oncogeni ad oncogeni
I meccanismi che portano alla trasformazione dei proto-oncogeni in oncogeni possono essere molteplici:
- Amplificazione del gene, fino ad aversi anche 100 copie dello stesso gene;
- traslocazione: si formano dei geni chimerici (A—-B traslocazione —AB—) che danno vita a proteine di fusione con significato oncogeno;
- mutazioni puntiformi: è il caso del gene RAS;
- traduzione in retrovirus acuti (solo in modelli sperimentali, nell’uomo non sono mai stati riscontrati);
- attivazione in CIS o in TRANS: sequenze retrovirali con capacità di amplificazione trascrizionale possono attivare a distanza le sequenze dei proto-oncogeni.
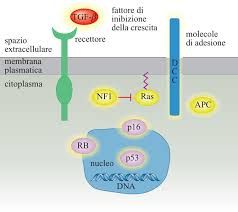
Ras
È una proteina monomerica molto importante localizzata di solito nel foglietto interno della membrana citoplasmatica. Quando un fattore di crescita raggiunge il recettore esso dimerizza e trasferisce il segnale mediante proteine adattatrici.
La Farnesil Transferasiα, fosforilata dal recettore attivo, lega la Farnesil Transferasi β che a sua volta lega p21 attaccandola alla membrana e attivandola.
L’attivazione modifica RAS che, in forma natia, lega il GDP mentre in forma attiva lega GTP. La forma attiva di RAS fosforila un’altra proteina, RAF, dando avvio ad una cascata di segnali che portano alla trascrizione di geni importanti per la crescita cellulare.
Il RAS torna in stato inattivo perché possiede un’attività GTPasica. Però questa attività è molto scarsa e necessita delle proteine GAP perché questa essa sia potenziata.
RAS mutata (o meglio se muta la parte di RAS, chiamata p21, che idrolizza GTP) perde la capacità GTPasica e la capacità di essere riconosciuta dalla proteina GAP: RAS è così costitutivamente attiva.

