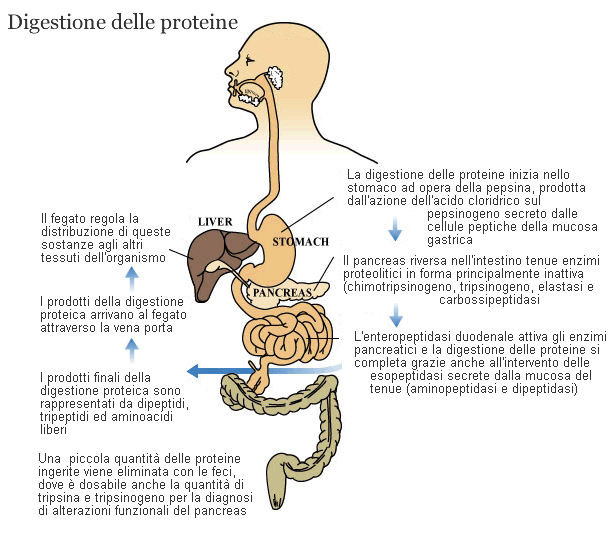
A differenza dei carboidrati e grassi non esiste un enzima per le proteine nella cavità orale, esiste solo l’effetto legato alla masticazione; poi a livello gastrico c’è una parziale distruzione delle proteine e loro idrolisi; ciò avviene ad opera di due fattori diversi: HCl e pepsina.

Pepsina
La pepsina è un enzima specifico secreto dalle cellule intestinali; la pepsina è secreta come pepsinogeno (stadio non attivo), è un endopeptinasi molto casuale; è attivato dall’acido cloridrico che fa staccare una parte di pepsinogeno e lo muta in pepsina (processo lento), subito dopo questo fenomeno la pepsina diviene attiva e a sua volta attiva altro pepsinogeno che viene secreto.
Le proteine tagliate sono presenti nel chimo e subito dopo passano nell’intestino dove va incontro alla successiva fase di digestione. L’ambiente ivi è acquoso e quasi neutro ad opera del succo pancreatico, la bile non è coinvolta nell’assorbimento delle proteine, sono invece coinvolti gli enzimi secreti dal pancreas; le cellule pancreatiche ricevono il messaggio ormonale della CCK, esiste inoltre un sistema nervoso legato all’attività del nervo vago.
All’interno delle cellule pancreatiche gli enzimi sono già preformati; questiono presenti in gran numero, ma non sono presenti nella loro forma attiva e sono chiamati Zimogeni (tripsinogeno, chimo-tripsinogeno, pro-elastasi, procarbossipeptidasi A, procarbossipeptidasi B). L’enzima che scatena l’attivazione di tutti questi enzimi è di origine intestinale , l’enzima si chiama enterochinasi.
Tripsina
L’enterochinasi attiva il tripsinogeno e lo trasforma in tripsina, la chimotripsinogeno e le due procarbossipeptidasi sono attivati poi a cascata dalla tripsina. Questi enzimi non sono casuali ma tagliano con specificità; esistono endopeptidasi ed esopeptidasi.
Digestione e assorbimento delle proteine
Endopeptidasi sono tripsina, chimotripsina ed elastasi. La tripsina taglia in corrispondenza della lisina ed arginina, la chimotripsina taglia gli amminoacidi aromatici e la elastasi in corrispondenza degli amminoacidi alifatici. Le carbossipeptidasi tagliano in corrispondenza delle parti carbossiliche. Questo tipo di digestione è detta endoluminale (all’interno del lume), la fase finale della digestione avviene poi grazie ad enzimi presenti sull’orletto a spazzola degli enterociti.
Gli enzimi coinvolti sono le carbossi-peptidasi e ammino-peptidasi che staccano un amminoacido alla volta dalla parte carbossilica e da quella amminica. I prodotti terminali della digestione sono singoli amminoacidi o dipeptidi e tripeptidi. L’assorbimento degli amminoacidi è un fenomeno complesso perché sulla membrana apicale degli enterociti c’è un elevato numero di sistemi di trasporto.
Questi sistemi danno luogo all’assorbimento degli amminoacidi con trasporto attivo o facilitato o tramite gradiente di diffusione.
Il sistema IMIMO
Esiste una specificità per più amminoacidi. Il sistema IMIMO si occupa degli amminoacidi. Dall’altra parte della membrana cellulare avviene la stessa cosa anche se ci sono minor sistemi di trasporto. Per ciò che riguarda i dipeptidi e tripeptidi sembrano essere assorbiti meglio dei singoli amminoacidi.
I dipeptidi e tripeptidi entrano per trasporto facilitato. Esiste la possibilità che le cellule intestinali possono assorbire polipeptidi più lunghi tramite endocitosi con una proteina detta Clatrina. La proteina introdotta può poi essere idrolizzata nella cellula, arrivare dall’altra parte della cellula e fuoriuscirvi oppure può essere modificata nel Golgi ed uscire dall’altra parte ed interagire con il sistema immunitario.