Che cos’è l’iperaldosteronismo
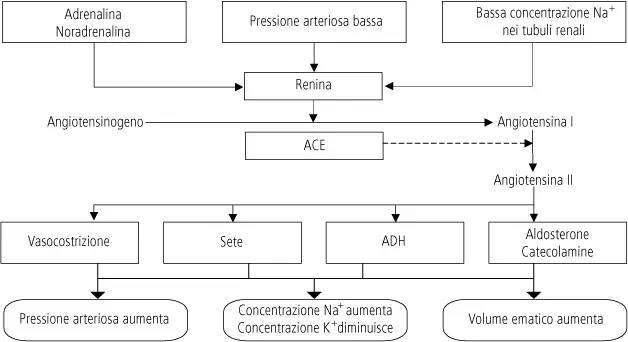
L’ Iperaldosteronismo è una malattia che origina dall’aumento di produzione di aldosterone da parte del surrene che provoca una diminuzione del potassio nel sangue.
Esistono due tipi di iperaldosteronismo:
- primario
- secondario
Di seguito parleremo del primario.
Iperaldosteronismo di tipo primitivo
Rappresenta la forma di ipertensione surrenale più frequente. Eccessiva ed inappropriata secrezione di aldosterone da parte della zona glomerulare del surrene → bassa attività reninica plasmatica, ipertensione ed ipopotassiemia. Produzione del cortisolo normale.
E’ possibile distinguere tre entità patologiche principali:
- adenoma corticosurrenale unilaterale benigno, ulteriormente classificato in due sottotipi:
-
- funzionante autonomamente o insensibile (adenoma secernente aldosterone, APA);
- sensibile (adenoma secernente aldosterone sensibile alla renina, AP-RA).
-
- iperplasia corticosurrenale, a sua volta suddivisa in:
- non autonoma (iperaldosteronismo idiopatico)
- autonoma (iperplasia surrenale primitiva)
- sensibile ai glucocorticoidi (iperaldosteronismo regredibile con i glucocorticoidi)
- carcinoma coricosurrenale (raro)
Segni clinici dell’iperaldosteronismo
Ipertensione e sintomi legati all’ipopotassiemia: stanchezza, ridotta resistenza, debolezza, apatia e cefalea.
Ipopotassiemia severa: alcalosi, poliuria, aumento della sete, parestesie, aritmie cardiache, tra cui la tachicardia ventricolare (palpitazione e dispnea).
L’eccessiva produzione di mineralcorticoidi non produce sintomi fisici caratteristici.
Pressione arteriosa elevata (205/123 mmHg), retinopatia di grado medio, emorragie raramente presenti.
Cuore lievemente ingrandito. I cambiamenti elettrocardiografici riflettono una modesta ipertrofia ventricolare sx e deplezione di potassio.
Diagnosi dell’iperaldosteronismo
- Ipopotassiemia: al momento delle indagini il paziente non deve assumere dieta iperpotassica o supplementi di cloruro di potassio e deve essere sospesa ogni terapia con diuretici (da almeno tre settimane);
- Assunzione di sale
- Valutazione del sistema renina-angiotensina-aldosterone
- Test all’infusione salina
Trattamento dell’adenoma producente aldosterone
- Localizzazione dell’adenoma: per identificare la sede dell’adenoma e stabilire il tipo di intervento chirurgico.
- Tecniche utilizzate: flebografia surrenalica, scintigrafia surrenalica, TAC e RMN.
- Opzioni terapeutiche:
- Preparazione all’intervento: trattamento con spironolattone, finchè non si siano normalizzate la pressionee la potassiemia. Il farmaco blocca i recettori dei mineralcorticoidi, riduce il volume del liquido extracellulare, promuove la ritenzione del K, attiva il sistema renina-angiotensina soppresso e quindi, facilita la sintesi di aldosterone da parte del surrene controlaterale.
- Intervento e terapia medica postintervento
Pseudoiperaldosteronismo
Comprende un gruppo eterogeneo di disordini clinici, in cui la secrezione dei mineralcorticoidi endogeni è bassa, con soppressione della renina.
Da cosa viene soppressa la renina
La renina è soppressa:
- dall’aumento della ritenzione di sodio
- dall’espansione di volume conseguenti o alla presenza di mineralcorticoidi endogeni o esogeni, o a sostanze simili ai mineralcorticoidi o ad un difetto tubulare del rene.
Sintomi: ipertensione, ipopotassiemia, alcalosi metabolica.
- Sindrome da apparente eccesso di mineralcorticoidi (difetto della 11β-idrossisteroido-deidrogenasi): ipertensione, ipopotassiemia, soppressione della renina, ma con ↓ aldosterone e DOC.
- Mutazione del gene che codifica la 11β-idrossisteroido-deidrogenasi di tipo 2 (isoenzima presente nel tubulo renale) → riduzione del metabolismo periferico del cortisolo in cortisone → accumulo di cortisolo e legame ai recettori dei mineralcorticoidi.
Trattamento: piccole dosi di desametasone per sopprimere ACTH e limitare, così, la produzione di cortisolo ed il suo accumulo.
- Ingestione cronica di liquerizia: agente responsabile il principio attivo della liquirizia: l’acido glicirrizico ed il suo metabolita acido glicirretinico. Entrambi ↓ l’enzima 11β-steroido-deidrogenasi nel rene → ↑ cortisolo libero.
- Sindrome di Liddle: ereditarietà autosomica dominante. Difetto nel dominio citoplasmatico della subunità β o γ del canale epiteliale del Na, con conseguente attivazione del canale stesso.
Farmaci: amiloride, trianterene: inibitori specifici di questo canale.
Meccanismi autocrini e paracrini
NO presente in molti tessuti, tra cui anche quelli del rene determina i seguenti effetti:
• vasodilatazione del circolo renale tramite la modulazione della vasocostrizione indotta da altre molecole;
• inibizione della secrezione di renina;
• modulazione della ripartizione del flusso ematico tra corticale e midollare.
Sistema delle endoteline: molecole sintetizzate dagli endoteliociti, attive sul sistema citoscheletrico delle fibrocellule muscolari liscie ed anche su altri citotipi di cui modulano l’attività contrattile.
- Recettore ETA → ET-1≥ET-2≥ET-3 → vasocostrizione
Stimolo alla sintesi di aldosterone - Recettore ETB → ET-1=ET-2=ET-3 → modulazione della vasocostrizione
Aggregazione piastrinica “in vivo”
Inibizione rilascio ADH → diuresi - Sistema dopaminergico:
- dilatazione dei vasi renali (tramite recettori D1);
- riduzione del riassorbimento del sodio (tramite i 2 recettori) per inibizione della pompa Na+/K+, antagonizzando l’azione stimolatoria su tale pompa esercitata dall’angiotensina II;
- inibizione rilascio di renina (tramite recettori D2).