La localizzazione delle proteine da purificare influenza le metodiche che possono essere impiegate per ottenere un estratto grezzo di partenza. Per le proteine solubili extracellulari, cioè secrete in fluidi extracellulari (brodo di coltura nel caso di microrganismi; oppure fluidi biologici quali sangue, latte, urina etc.) in genere basta concentrare il liquido, perché la quantità di proteine presenti è ridotta (nel caso del sangue, occorre anche rimuovere la parte corpuscolata per ottenere il plasma).
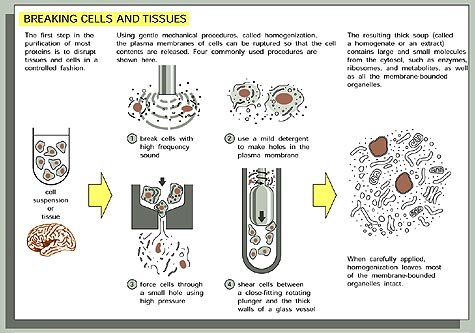
Più frequentemente, le proteine d’interesse sono solubili intracellulari. In questo caso occorre omogeneizzare le cellule e rimuovere i componenti subcellulari che non interessano mediante centrifugazione (ad es., se la proteina che si vuole purificare è citosolica, è possibile rimuovere tutti gli organelli con un’unica centrifugata ad alti g per alcune ore e recuperare il sovranatante).
Nel caso dei batteri, la lisi cellulare, seguita da una breve centrifugazione per rimuovere membrane e pareti, ci lascia con un sovranatante particolarmente viscoso per la presenza di acidi nucleici. Per rimuoverli, si può trattare l’estratto con enzimi che idrolizzano i polinucleotidi (DNAsi) oppure con sostanze che li precipitano (polietilenimmina, protammina etc.).
Spesso capita di dovere purificare delle proteine solubili intracellulari ricombinanti, espresse in microrganismi. Questo può presentare parecchi vantaggi e qualche svantaggio. Le proteine ottenute con tecnologie ricombinanti sono generalmente overespresse, e quindi presenti in elevate quantità entro le cellule – talvolta arrivano a rappresentare oltre il 20% della proteina totale intracellulare. Inoltre, in molti casi, queste proteine clonate in vettori d’espressione sono dotate di ‘tags’, vale a dire sequenze-etichetta inserite all’estremità N-terminale (classico esempio, una ‘coda’ di istidine) allo scopo specifico di facilitare la purificazione.
Un inconveniente che si osserva spesso con le proteine ricombinanti è che queste, pur essendo di per se solubili, vengano accumulate entro le cellule batteriche sotto forma di aggregati insolubili (‘corpi d’inclusione’, visibili come ammassi neri nella microfotografia a lato) dispersi nel citoplasma, spesso a livello polare. Anche dai corpi d’inclusione talora si può ottenere la proteina in forma attiva. Occorre separare dapprima gli aggregati proteici dall’omogenato, solubilizzarli con alte concentrazioni di agenti denaturanti (ad es., 8 M urea) e quindi diluire la soluzione rimuovendo il denaturante mediante dialisi.
Per quanto riguarda le proteine di membrana, la purificazione è particolarmente difficoltosa, perché non sono rilasciabili con tecniche tradizionali (soprattutto le proteine intrinseche di membrana) e spesso sono anche instabili. È possibile cercare di solubilizzare la proteina partendo dall’intero tessuto omogeneizzato, oppure isolare intatto il comparto subcellulare cui le proteine di membrana appartengono (esempio: i mitocondri per la citocromo ossidasi) e poi solubilizzare la proteina (in questo caso le rese sono minori, ma l’attività specifica è generalmente maggiore).