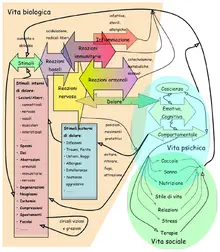
Le diverse modalità sensoriali, quindi i diversi stimoli che possono provenire sia dal mondo esterno, sia dall’interno dell’organismo vengono trasdotti ad opera dei recettori, rappresentati da terminazioni libere o strutture corpuscolare, che hanno la capacità di trasformare l’energia associata allo stimolo in una energia nervosa, cioè elettrica. Da tutto il corpo prendono origine alcune modalità sensoriali che, proprio per questo motivo, sono dette somatiche. La sensibilità somatica comprende diverse modalità che sono: sensibilità tattile, a sua volta distinta in una sensibilità tattile cosiddetta “epicritica” e una cosiddetta “protopatica”, una sensibilità propriocettiva ed infine la sensibilità nocicettiva. Queste sono dei tipi di sensibilità che possono provenire da qualunque parte del corpo.
La sensibilità tattile epicritica è quella che viene definita sensibilità “fine” perchè è quella che consente di riconoscere gli oggetti anche ad occhi chiusi, ammesso che di detto oggetto si abbia esperienza. La sensibilità tattile protopatica è considerata, invece, una sensibilità “grossolana”, cioè quella che segnala il contatto avvenuto con un determinato oggetto, ma che di fatto non consente di percepirne le caratteristiche. La sensibilità propriocettiva è quella che consente di avere la percezione di sé nello spazio.
Trasmissione a livello centrale degli stimoli nocicettivi:
Parlare di sensibilità nocicettiva è più corretto che parlare di sensibilità dolorifica perché in realtà ciò di cui si parla è una sensibilità oggettiva, mentre invece il dolore è in genere un’esperienza soggettiva. Quando si parla di strutture che trasducono stimoli nocicettivi e li trasmettono al SNC si preferisce parlare di sensibilità nocicettiva o di sistema nocicettivo. Come per tutte le sensibilità esistono dei recettori, ossia strutture in grado di transdurre trasformando in impulso nervoso l’energia associata alla noxa. I recettori per gli stimoli nocicettivi sono terminazioni libere, ossia sono strutture corpuscolate specializzate. Sono fibre di tipo Aδ o di tipo C. Le fibre di tipo C sono terminazioni amieliniche a conduzione lenta(pochi m\s), mentre, invece, la conduzione nelle fibre Aδ, che sono fibre mieliniche, è più veloce ( tra 15 e 30 metri al secondo). L’attivazione di queste fibre risponde anche alle caratteristiche che si associano alla sensazione che abbiamo di dolore.
Quando si applica una noxa la sua percezione inizialmente è quella di un “dolore pungente”, ben distinto, ed è dovuta alla trasmissione veloce delle fibre Aδ. Ne consegue una sensazione secondaria di “dolore urente”, un dolore più diffuso e meno circoscritto, dovuta alla trasmissione amielinica delle fibre di tipo C. I recettori per le noxae possono essere distinti in recettori di tipo unimodale, di tipo polimodale e di tipo silente. I recettori di tipo unimodale rispondono ad uno specifico tipo di noxa: possono essere termocettori che rispondono ad una temperatura superiore ai 45 ºC o inferiore ai 5ºC, oppure chemocettori sensibili a sostanze chimiche nocive per l’organismo, possono essere ancora meccanocettori sensibili allo stimolo meccanico molto intenso. I recettori polimodali sono quelli che rispondono a più di un tipo di queste energie.
I recettori silenti sono in fine quelli che normalmente non sono attivi ma lo diventano se si sviluppa un processo come l’infiammazione: in questo caso i recettori in questione sono responsabili della condizione di ”iperalgesia” da infiammazione. Ossia a parità di stimolo, nella trasduzione in cui ci sia la concomitanza di un processo flogistico si ha una ipersensibilità che fa si che uno stimolo non doloroso in condizioni normali venga percepito come doloroso, normalmente questi recettori sono meccanocettori. L’iperalgesia può essere o di tipo locale, come in caso di infiammazione, oppure può manifestarsi come conseguenza di un fenomeno di apprendimento che avviene a livello di integrazione nel midollo spinale, ciò prende il nome di “wind-up”.
Queste fibre arrivano al midollo spinale attraverso le radici posteriori dei nervi spinali, e a livello della sostanza grigia fanno sinapsi con diverse lamine di Rexed, più in particolare con le lamine sensitive 1, 2, 5 e poi, attraverso degli interneuroni con lamina 10 che è, invece, una lamina motoria. Il percorso che queste fibre possono fare è duplice perché danno luogo a due vie: il riflesso flessorio e “il lemnisco spinale”. Questa ultima via proietta attraverso degli interneuroni verso strutture soprastanti la sensibilità nocicetiva. Il lemnisco spinale è chiamato anche sistema spino-talamico. A livello delle corna posteriori il neurotrasmettitore di queste fibre è il glutammato; il glutammato agisce a questo livello(lamine di Rexed) attraverso due tipi di recettore che sono recettori ionotropi, più precisamente i recettori AMPA-kainato ed NMDA (N-metil delta aspartato), oppure recettori di tipo metabotropo.
Nel primo caso il potenziale eccitatorio è più rapido, meno rapido nel secondo tipo di recettori. La presenza del glutammato a questo livello fa si che questi neuroni possano modulare la loro risposta in relazione allo stimolo e possano in qualche modo presentare dei fenomeni plastici che prendono il nome nel loro complesso di “wind-up”. Ciò significa che la sensazione dolorifica raramente è un fenomeno soggetto all’adattamento, quasi mai anzi. In genere si può avere un dolore che si protrae nel tempo rispetto al quale addirittura la soglia può diminuire, come se in qualche modo l’organismo imparasse a percepire il dolore. Questa plasticità rispetto allo stimolo nocicettivo è legata proprio a fenomeni plastici che si verificano a livello dei neuroni delle corna grigie posteriori del midollo spinale poiché a questo livello si verifica un fenomeno plastico molto simile a quello riscontrato nell’ippocampo nel potenziamento a lungo termine: succede che normalmente quando il glutammato agisce sui recettori ionotropi c’è il passaggio di ioni Na e ioni Ca all’interno della cellula, quindi si crea un potenziale post-sinaptico eccitatorio di tipo rapido.
Il WIND-UP costituisce un progressivo incremento registrato nei neuroni delle corna posteriori del midollo spinale ed in quelli motori delle corna anteriori del numero dei potenziali d’azione scatenati in seguito a stimolazione delle fibre C ad una frequenza maggiore di 0.5 Hz. Quando la frequenza di stimolazione di una singola radice dorsale raggiunge gli 0.5 Hz, il potenziale eccitatorio post-sinaptico (EPSPs) totale nelle cellule delle corna anteriori produce una depolarizzazione cumulativa che si esprime in una raffica di potenziali d’azione, invece, che in un singolo potenziale d’azione per ogni stimolo a livello della radice posteriore. Quando la stimolazione ad alta frequenza viene interrotta, i potenziali d’azione si protraggono ancora per 60 secondi (intervallo corrispondente alla durata della depolarizzazione delle cellule delle radici dorsali) per poi cessare. L’utilizzazione di una stimolazione a bassa frequenza riduce notevolmente l’insorgenza del wind-up, insorgenza che viene completamente abolita dall’uso degli antagonisti recettoriali dell’N-Metil-D-Aspartato, noto come NMDA. Viene suggerito che il fenomeno del wind-up può essere visto come la sommazione temporale di EPSPs mediati dal recettore per l’NMDA.
Nel caso in cui la stimolazione sia continuata o si somministri uno stimolo soprasoglia, si attivano oltre ai recettori normalmente attivati da un determinato stimolo, anche dei recettori che normalmente sono bloccati dalla presenza di ioni Mg2+ e che, quindi, normalmente non darebbero un potenziale post-sinaptico eccitatorio. Se c’è una applicazione a lungo termine si assiste a fenomeni di slatentizzazione di alcuni geni che inducono la sintesi di determinate proteine in grado di facilitare il rilascio del neurotrasmettitore e facilitare l’azione del neurotrasmettitore sulla componente post-sinaptica aumentando a questo livello la concentrazione di recettori specifici. Tutti questi fenomeni prendono il nome di wind-up e fanno si che nel corso dell’applicazione continuata di una noxa l’organismo reagisca abbassando la soglia del dolore a questa noxa in un fenomeno di iperalgesia.
Si ritiene che qualcosa di simile sia anche alla base di un fenomeno che prende il nome di ”alodimia”, ossia la percezione dolorosa dell’applicazione di uno stimolo che di per sé non è una noxa. I neuroni di secondo ordine prima di proiettare ai livelli soprastanti si decussato in genere dopo aver percorso, in senso ascendente, due o tre segmenti del midollo spinale. Quindi proiettano come fascio spino-talamico o sistema lemniscale spinale. Il fascio spino-talamico risulta costituito a sua volta di diversi fasci: il fascio paleo-spino-talamico, il fascio neo-spino-talamico, il fascio spino-reticolare e il fascio spino-mesencefalico.
Questi fasci sembrano avere funzioni diverse all’interno della sensibilità nocicettiva:
• Il fascio Neo-Spino-Talamico proietta a nuclei talamici specifici, più precisamente al complesso ventro-basale del talamo, e si ritiene sia responsabile degli aspetti discriminativi del dolore;
• Il fascio Paleo-Spino-Talamico proietta ai nuclei talamici aspecifici, dai quali, a loro volta proiettano in modo diffuso alla corteccia, e sarebbero, quindi, responsabili della reazione di allerta che normalmente si accompagna al dolore. Inoltre, alcune di queste fibre arrivano anche al sistema limbico e sarebbero responsabili degli aspetti emotivi che normalmente si accompagnano alla sensazione di dolore, comprese le reazioni emotive;
• Il fascio Spino-Reticolare proietta alla sostanza reticolare ascendente che, a sua volta, proietta ai nuclei intralaminari del talamo, dai quali, a loro volta proiettano in modo diffuso alla corteccia, e sarebbero, quindi, responsabili della reazione di allerta che normalmente si accompagna al dolore. Inoltre, alcune di queste fibre arrivano anche al sistema limbico e sarebbero responsabili degli aspetti emotivi che normalmente si accompagnano alla sensazione di dolore, comprese le reazioni emotive;
• Il fascio Spino-Mesencefalico proietta ad alcune strutture del tronco dell’encefalo, tra cui il grigio periacqueduttale, da cui hanno origine fibre discendenti con funzione di controllo sulla trasmissione a livello centrale degli stimoli nocicettivi e che nel loro complesso costituiscono il “sistema anti-nocicettivo centrale” o sistema anti-nocicettivo endogeno.
In generale il sistema dolorifico non permette solo di percepire il dolore ma è un sistema di difesa, perché avere la sensazione di dolore rispetto ad un determinato stimolo è anche un meccanismo che l’organismo utilizza per difendersi. Nel complesso, quindi, il sistema nocicettivo è un sistema di difesa contro eventuali pericoli a cui l’organismo può andare incontro. Gli stimoli nocicettivi non derivano solo dall’esterno, ma possono essere anche endogeni: tutti gli organi ad eccezione del cervello e del fegato sono provvisti di nocicettori e diverse condizioni possono dar luogo a una sensazione dolorosa cosiddetta “viscerale” in quanto origina dai visceri interni all’organismo.
Queste situazioni sono normalmente legate ad ischemia, infiammazione o a processi neoplastici e possono dar luogo ad un dolore viscerale che viene trasmesso a livello centrale con le stesse modalità del dolore somatico. C’è una caratteristica del dolore viscerale che è quella di, in alcuni casi, avere una percezione superficiale, di dolori che in realtà originano da visceri. Si parla di ”dolore riferito”: in caso di infarto del miocardio il paziente si lamenta di un dolore che ha localizzazione a livello toracico che qualche voltasi irradia al braccio sinistro. La spiegazione che si dà di questo fenomeno è che i nocicettori cutanei e i nocicettori dell’organo viscerale proiettano agli stessi neuroni a livello delle corna posteriori. Si dice che hanno la stessa origine metamerica. Quindi, di fatto, per abitudine il cervello è in grado di riferire il dolore che proviene da un viscere come attribuito al dermatomero corrispondente. Questo appunto solo per la più alta probabilità di prendere un colpo al torace durante il corso della vita che di avere un infarto. Vale la stessa cosa per l’appendicite, il dolore della colecisti, etc.